Миелолейкоз
Содержание:
- Острый миелолейкоз
- Фазы развития недуга
- Фазы хронического миелолейкоза
- Терапия патологии
- Основные симптомы острого лейкоза миелобластного типа
- Общие сведения
- Лечение
- Профилактика
- Диагностика заболевания
- Патогенез (что происходит?) во время Хронического миелоидного лейкоза:
- Клинические проявления заболевания
- Патогенез (что происходит?) во время Хронического миелоидного лейкоза:
- Прогноз жизни при остром миелоидном лейкозе
- Хронический миелолейкоз
Острый миелолейкоз
Это заболевание относится к злокачественной патологии миелоидных клеток, в результате которой они проходят быстрый процесс размножения и замещения, подавляя при этом рост здоровых клеток крови. Симптоматика острого миелолейкоза складывается из процессов замещения клеток костного мозга на лейкемические, а это становится причиной снижения нормальных лейкоцитов, эритроцитов и тромбоцитов.
Миелолейкоз острой формы характеризуется появлением признаков утомляемости, одышки, мелких повреждений кожи с повышенной кровоточивостью и инфекционными осложнениями.
На сегодня до конца не известны причины возникновения этого заболевания. Но были выявлены некоторые факторы, которые способствуют развитию острого миелолейкоза. К ним можно отнести ионизирующую радиацию, воздействия вредных веществ и мутации на генетическом уровне.
Многие симптомы при острой форме миелолейкоза вызываются процессами замещения нормальных кроветворных клеток опухолевыми. Недостаточное количество лейкоцитов приводит к снижению иммунной защиты и повышает восприимчивость больных к инфекциям. Уменьшение эритроцитов вызывает анемию, которая выражается в усталости, бледности кожных покровов и затруднённом дыхании. Сниженные показатели тромбоцитов приводят к лёгкому повреждению кожных покровов и к повышению кровоточивости.
В самом начале заболевания острый миелолейкоз может протекать в виде признаков гриппозного состояния с лихорадкой, усталостью, потерей веса или снижением аппетита, одышкой, анемией, появлением гематом, болей в суставах и костях, с присоединением инфекций.
При остром миелолейкозе наблюдается незначительная и бессимптомная спленомегалия. Также отмечается не частое увеличение лимфоузлов. Иногда при этой форме миелолейкоза появляются изменения на коже и синдром Свита.
Кроме того, у больных диагностируют припухлость в области дёсен в результате инфильтрационного процесса лейкозных клеток в ткани. В некоторых случаях выявляют как первый признак заболевания хлорому – плотную опухолевую массу вне костного мозга.
В редких случаях острый мииелолейкоз обнаруживают при профилактическом осмотре благодаря общему анализу крови на фоне бессимптомного протекания болезни.
Как правило, миелолейкоз в острой форме развивается очень стремительно и без соответствующего лечения может обернуться для больного летальным исходом в течение нескольких месяцев и даже недель.
Прогноз при остром миелолейкозе с пятилетней выживаемостью может колебаться от 15 до 70%, а ремиссии – до 78%. И это будет зависеть от подвида злокачественного заболевания.
Фазы развития недуга
Специалисты выделяют три фазы при миелолейкозе:
- хроническая;
- акселеративная;
- терминальная (бластный криз).

Продолжительность хронической стадии составляет порядка 4 лет. Основная масса больных именно на этом этапе узнает о своем недуге. Для нее характерно постоянство, минимальные проявления недуга.
Обнаруживается проблема при сдаче крови – результаты исследований наводят на подозрения. На внешние проявления внимания не обращают.
Вторая стадия – акселеративная. Патологические процессы становятся явными и стремительными, количество лейкоцитов в незрелой форме возрастает. Занимает это около полутора лет. Чтобы повысить вероятность возвращения состояния больного к хронической стадии, нужно подобрать подходящее лечение.
Фазы хронического миелолейкоза
- Хроническая фаза. В этой фазе находится большинство пациентов, которые обращаются к врачу (около 85%). Средняя продолжительность – 3 – 4 года (зависит от того, насколько своевременно и правильно начато лечение). Это стадия относительной стабильности. Пациента беспокоят минимальные симптомы, на которые он может не обращать внимания. Иногда врачи выявляют хроническую фазу миелолейкоза случайно, при проведении общего анализа крови.
- Фаза акселерации. Во время этой фазы патологический процесс активируется. Количество незрелых белых кровяных телец в крови начинает быстро нарастать. Фаза акселерации является как бы переходной от хронической к последней, третьей.
- Терминальная фаза. Финальная стадия болезни. Возникает при нарастании изменений в хромосомах. Красный костный мозг практически полностью замещается злокачественными клетками. Во время терминальной стадии пациент погибает.
Терапия патологии
Терапия хронического миелолейкоза определяется стадией патологии. На ранней стадии рекомендовано общеукрепляющее лечение, сбалансированное, обогащенное витаминами питание, регулярный диспансерный контроль. В остальных случаях при ХМЛ применяют медикаментозные средства, способствующие уменьшению величины селезенки и понижению активности злокачественных клеток. От адекватности и своевременности проводимой терапии напрямую зависит продолжительность жизни больного. Терапия осуществляется несколькими методами:
- Медикаментозное лечение (Цитозар, Альфа-интерферон, Миелосан);
- Трансплантация костного мозга (вероятность выздоровления выше при операции на ранних стадиях течения патологии, предпочтительные доноры – родственники пациента);
- Лучевая терапия (цель – уничтожение злокачественных клеток, сокращение темпов их развития);
- Удаление селезенки (обычно на последней стадии развития патологии). Показаниями к хирургическому вмешательству могут служить тромбоцитопения, угроза повреждения селезенки, явный дискомфорт, вызванный размерами органа.
Если прием лекарственных препаратов не дает ожидаемого эффекта, применяют лейкофорез – клеточное очищение крови от чрезмерного количества лейкоцитов. Иногда его применяют параллельно с медикаментозным лечением. На значительно увеличенную селезенку иногда воздействуют рентгеновскими лучами, это способствует уменьшению ее величины. При возникновении гнойных воспалительных очагов применяют антибиотики.
При развитии выраженной анемии, толерантной к цитостатикам, или при терапии железодефицитной анемии соответствующими препаратами железа показано переливание крови. Пациенты подлежат постановке на диспансерный учет, им необходимы регулярные осмотры и наблюдение за показателями крови. Самостоятельная терапия хронической формы миелоидного лейкоза несостоятельна и недопустима.
Прогрессирование патологии
При развитии патологии показаны цитостатики. Масштабность проводимого лечения зависит от фазы заболевания. Возникновение явных симптомов (увеличение органов, рост числа лейкоцитов в сравнении с более ранней стадией патологии) – повод для применения первично-сдерживающих подходов. Пациентам в небольших дозах амбулаторно прописывают гидроксимочевину – при условии контроля показателей крови. После ремиссии заболевания применяют поддерживающее лечение.
Развернутая стадия патологии
Если заболевание перешло в развернутую стадию, медикаментозное лечение проводят в зависимости от «группы риска» (гематологические показатели). При незначительных рисках изначально осуществляют лечение одним препаратом (монохимиотерапия), при высоком сразу рекомендуется применять несколько лекарственных средств одновременно (полихимиотерапия).
Завершив курс монохимиотерапии, сначала назначают то же средство, но в большей дозировке. При улучшении показателей крови его отменяют или снижают дозировку. Если применявшийся цитостатик не принес ожидаемого эффекта в течение месяца, осуществляют лечение другим лекарственным препаратом.
После курса химиотерапии проводят поддерживающее лечение (схема схожа со схемой первично-сдерживающей терапии). Используют лекарственные средства, оказавшиеся эффективными при курсовом лечении. Полихимиотерапию осуществляют при повышенной степени риска и на последней стадии ХМЛ. При бластном кризе терапия схожа с лечением острой лейкемии. Полихимиотерапию проводят короткими курсами по 5-14 дней. Продолжительность перерывов составляет 7-10 дней.
Альфа-интерферон
К принципиально новым средствам терапии хронического миелолейкоза относят альфа-интерферон – антагонист факторов роста. Он тормозит влияние мегакариоцитов на процесс кроветворения и препятствует размножению гранулоцитов. Помимо этого, альфа-интерферон активизирует противоопухолевый иммунитет, создавая условия для нормализации кроветворения.
Являясь цитостатиком, лекарственное средство не оказывает депрессивного воздействия на здоровые клетки. Лечение альфа-интерфероном может вызвать и цитогенетическую ремиссию – отсутствие филадельфийской хромосомы. Это говорит даже не о ремиссии, а о полном выздоровлении пациента.
Мер профилактики хронического миелолейкоза не существует. Возможно только предупреждение обострений патологии (поддерживающее лечение, предотвращение инсоляции, простудных болезней). Средняя продолжительность жизни при ХМЛ – три-пять лет, иногда – до восьми. После развития бластного криза больному редко удается прожить больше года.
Основные симптомы острого лейкоза миелобластного типа
Четко обозначенной симптоматики, присущей этому заболеванию, нет. Его проявления зависят от возраста больного, состояния здоровья, наличия сопутствующих патологий, разновидности ОМЛ и других обстоятельств. Кроме того, симптомы появляются постепенно, от более легких к более тяжелым, что смазывает картину и затрудняет своевременную постановку диагноза.
Наиболее часто о вероятности развития острой миелоидной лейкемии свидетельствуют:
- на ранних стадиях — постоянная слабость, утомляемость, упадок сил;
- недомогание по типу простуды с небольшим повышением температуры тела;
- анемия;
- повышенная потливость, отеки рук, ног и лица;
- на более поздних стадиях – поражения слизистых;
- увеличение печени, селезенки, лимфоузлов, иногда — миндалин;
- боли в позвоночнике, костях, суставах, изменения в костной ткани по типу остеопороза.
При остром миелобластном лейкозе прогноз жизни напрямую зависит от того, насколько рано начато лечение
Поэтому целесообразно обратить внимание уже на первые симптомы болезни, несмотря на то, что они являются неспецифичными. И нанести визит врачу
Диагностика патологии
Как и при любой разновидности лейкемии, при остром лейкозе миелоидной формы пациент сдает анализы крови – общий и биохимический. С целью установления диагноза и уточнения стадии ОМЛ лабораторно исследуется периферическая кровь. Отклонения, с высокой долей вероятности указывающие на лейкоз, наблюдаются по целому ряду показателей ОАК – в эритроцитах, тромбоцитах, лейкоцитах, лимфоцитах, других типах клеток.
В биохимическом исследовании анализируют в первую очередь уровень мочевой кислоты, некоторых ферментов и витамина В12. Отклонения от референсных значений по этим показателям – дополнительный повод для проведения более тщательного обследования.
Если результаты анализов предполагают наличие у пациента ОМЛ, он направляется на биопсийную пункцию костного мозга. Забор гомеопоэтических стволовых клеток осуществляется с целью пересчета незрелых лейкоцитов. Если их количество значительно превышает норму, можно с уверенностью говорить об остром миелоидном лейкозе.
Дополнительными методами исследования являются ЭКГ, МРТ, рентгенография, осмотр и консультации смежных специалистов – если болезнь затронула те или иные органы и ткани. Также, поскольку основной предпосылкой для старта заболевания на сегодняшний день принято считать наследственный фактор, с целью определения оптимальной стратегии и тактики лечения острого миелобластного лейкоза врач может направить пациента на генетическое исследование.
Как лечат острый миелобластный лейкоз
Наиболее эффективным методом борьбы с данным заболеванием является трансплантация костного мозга. В этом случае пациент получает здоровые стволовые клетки, которые, начиная делиться, восполняют недостаток нормальных клеток крови. Однако этот метод сопряжен со многими сложностями, в частности:
поиск подходящего по максимальному количеству параметров донора может занять время, которого у больного зачастую просто нет;
для того, чтобы организм реципиента не отторгнул донорскую субстанцию, перед пересадкой костного мозга он подвергается агрессивной иммуноподавляющей терапии
В этот период человек становится уязвимым к любым инфекциям, поэтому важно соблюдать абсолютную стерильность в месте его нахождения;
хотя сама трансплантация может проводиться в рамках ОМС, расходы, связанные с обследованием неродственных доноров и лечением возможных осложнений, например, отторжения, несет пациент или его близкие. Поэтому процедура обходится достаточно дорого.
В силу вышеперечисленного наиболее распространенным и востребованным методом лечения ОМЛ на сегодняшний день все еще остается химиотерапия. Она позволяет добиться длительной устойчивой ремиссии, а иногда – и полного выздоровления пациента, хотя окончательный прогноз при остром миелобластном лейкозе после такого лечения менее благоприятный с точки зрения возникновения рецидивов, чем при трансплантации костного мозга.
Помимо этого, в рамках терапии пациенту назначают лечение, поддерживающее или восстанавливающее иммунитет, а также направленное на снятие симптомов обострения хронических заболеваний.
Общие сведения
Хронический миелоидный лейкоз – одно из медленно прогрессирующих, но при этом очень опасных злокачественных заболеваний. В процессе развития болезни те клетки, которые при нормальном состоянии организма развиваются в базофилы, эозинофилы, нейтрофилы, моноциты, приобретают злокачественную природу.
К сожалению, люди, у которых развивается миелолейкоз, что это такое преимущественно узнают не на самых ранних этапах. Ведь в первое время их беспокоят только неспецифические признаки – слабость, плохой аппетит, потеря веса. По мере развития болезни увеличивается селезенка и лимфоузлы, проявляются другие признаки. Лечение проводят ингибиторами тирозинкиназы, иногда требуется пересадка стволовых клеток. При правильном подходе к лечению жизнь пациента удается продлить и сохранить ее качество.
Хронический миелолейкоз, код по МКБ-10 которого — C92.1, может поражать людей в любом возрасте. Но все же чаще всего хронический миелолейкоз диагностируется у людей 40-60 лет. В большинстве случаев – примерно в 90% — болезнь развивается в хронической форме. Заболевание не является наследуемой патологией.
О том, как проявляется эта болезнь, а также о наиболее прогрессивных методах ее лечения речь пойдет в этой статье.
Лечение
В лечении заболевания применяются цитостатики
Для уменьшения пролиферации атипичных клеток при тромбоцитозе высокой степени, многолетнем выраженном увеличении печени и селезёнки и очагах кроветворения в них используются цитостатические препараты. С целью химиотерапии пациента обязательно помещают в гематологическое отделение, лечение происходит циклами и в сумме может занять до 9-12 месяцев. Чаще для лечения используют циклофосфан, миелобромол и препараты гидроксимочевины.
Если заболевание протекает доброкачественно, при этом нет выраженного увеличения или уменьшения количества клеток кровотока, а печень и селезёнка нормальных размеров, лечение состоит лишь из общеукрепляющих методов. Пациенту рекомендуется ограничить физическое и эмоциональное напряжение, избегать переохлаждения и респираторных инфекций, полноценно питаться, принимать витамины и иммуномодуляторы.
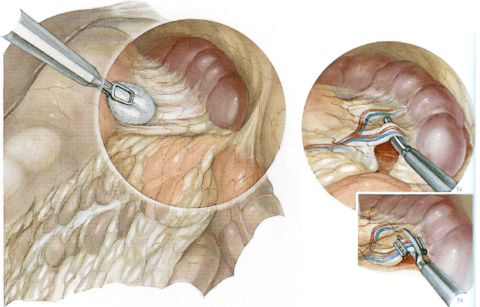
Симптоматическое лечение — удаление селезенки
Иногда используется симптоматическое и патогенетическое лечение:
- в случае увеличения мочевой кислоты в крови назначают аллопуринол;
- при анемии назначают анаболические стероиды на 3-6 месяцев, но в случае её усугубления за время лечения можно перелить пациенту эритроцитарную массу (при уровне гемоглобина менее 70 г/л);
- в случае тяжёлой гемолитической анемии вследствие усиления функций селезёнки возможно выполнение спленэктомии, то есть операции по удалению этого органа.
Наиболее современным и действенным методом всё-таки считается трансплантация больному донорских стволовых клеток для обновления генераций предшественников кроветворения, однако широкого применения этот метод пока не получил.
Профилактика
Нет рекомендаций по первичной профилактике ХМЛ.
Всем пациентам с ХМЛ:
- профилактика фоновых предопухолевых заболеваний и состояний,
- приверженность ЗОЖ,
- исключение хронических интоксикаций,
- ограничение контакта с вредными производственными факторами,
- участие в мероприятиях диспансеризации.
Диспансерное наблюдение для оценки эффективности терапии, контроля побочных действий и лекарственной токсичности:
- не реже 1 раза в триместр на первом году терапии,
- не реже 1 раза в полугодие в последующем.
Организация оказания медицинской помощи
При выявлении у больного ХМЛ или подозрении на него больного направляют на консультацию:
- в центр амбулаторной гематологической/онкологической помощи;
- в первичный гематологический кабинет;
- в первичное гематологическое отделение медицинской организации.
Гематолог организует диагностику или направляет в медорганизацию.
Показания для плановой госпитализации:
1. проведение плановых гемотрансфузий при анемии, тромбоцитопении 3 степени;
2. коррекция побочных эффектов терапии;
3. необходимость обследования для выбора оптимальной тактики ведения;
4. плановая терапия пациентов с комплексной сопутствующей патологией, требующей госпитального наблюдения.
Показания для экстренной госпитализации:
1. проведение срочных гемотрансфузий при тромбоцитопении с геморрагическим синдромом, анемии 4 степени;
2. остро возникшие состояния после курсов терапии;
3. коррекция жизнеугрожающих состояний.
Показания к выписке пациента из стационара:
1. купирование состояний, приведших к госпитализации;
2. возможность продолжения амбулаторного лечения;
3. отказ больного от лечения;
4. нарушение режима при отсутствии опасности для жизни больного и здоровья окружающих;
5. перевод в другую медицинскую организацию.
Диагностика заболевания
Хронический миелолейкоз диагностируется по результатам проведенных лабораторных исследований наряду с особенностями общей клинической картины недуга. Актуальными будут методики:
- Исследование крови. Позволяет выявить показатели крови и их соотношение. На фоне развития недуга происходит возрастание белых клеток крови, пребывающих в незрелой форме. По мере усугубления патологического процесса сокращаются показатели тромбоцитов, эритроцитов.
- Биохимические исследование показателей крови. Методика позволяет определить нарушения в функционировании селезенки и печени, которые начинаются из-за проникновения незрелых лейкоцитов.
- Цитогенетический анализ, предполагающий выполнение исследования хромосом. Если заболевание начинает развиваться, в лейкозных клетках присутствует аномальная хромосома, именуемая филадельфийской, которая отличается урезанным видом.
- Аспирация и биопсия костного мозга. Исследование позволяет получить максимум информации. В идеале их выполняют сразу, забирая материал для исследования с задней области бедренной кости.
- Гибридизация, направленная на определение аномальных хромосом.
- МРТ и КТ.
- Ультразвуковое исследование.
Первичные признаки хронического миелолейкоза определяются посредством анализа крови, когда в нем прослеживается высокий уровень гранулоцитов. Это требует проведения дополнительных исследований и дифференцированной диагностики. Возникает необходимость в гистологическом исследовании.
Патогенез (что происходит?) во время Хронического миелоидного лейкоза:
Считается, что ключевую роль в возникновении хронического миелолейкоза играет транслокация t(9;22), приводящая к образованию химерного гена BCR-ABL1. При этом 1-й экзон гена ABL1 замещается различным числом 5′-концевых экзонов гена BCR. Химерные белки Bcr-Abl (один из них — белок p210BCR-ABL1) содержат N-концевые домены Bcr и С-концевые домены Abl1.
Способность химерных белков вызывать опухолевую трансформацию нормальных стволовых кроветворных клеток продемонстрирована in vitro.
Об онкогенности белка p210BCR-ABL1 свидетельствуют также эксперименты на мышах, получивших летальную дозу облучения. Когда им трансплантировали клетки костного мозга, которые были заражены несущим ген BCR-ABL1 ретровирусом, у половины мышей развивался миелопролиферагавный синдром, напоминавший хронический миелолейкоз.
Другие доказательства роли белка p210BCR-ABL1 в развитии хронического миелолейкоза следуют из экспериментов с антисмысловыми олигонуклеотидами, комплементарными транскрипту гена BCR-ABL1. Показано, что эти олигонуклеотиды подавляют рост колоний опухолевых клеток, при этом нормальные гранулоцитарные и макрофагальные колонии продолжают расти.
Слияние гена BCR с геном ABL1 приводит к тому, что увеличивается тирозинкиназная активность белка Abl1, ослабевает его способность связываться с ДНК, а связывание с актином усиливается.
В то же время детальный механизм перерождения нормальных клеток костного мозга в опухолевые неизвестен.
Механизм перехода заболевания от развернутой стадии к бластному кризу тоже неясен. Опухолевому клону присуща ломкость хромосом: помимо транслокации t(9;22) в опухолевых клетках могут появиться трисомия по 8-й хромосоме, делеция в 17р. Накопление мутаций приводит к изменению свойств опухолевых клеток. По данным одних исследователей, скорость развития бластного криза зависит от локализации точки разрыва гена BCR. Другие исследователи эти данные опровергают.
У ряда больных развитию бластного криза сопутствуют разнообразные мутации гена TP53 и гена RB1. Изредка встречаются мутации генов RAS. Есть единичные сообщения о появлении у больных хроническим миелолейкозом белка p190BCR-ABL1 (его часто обнаруживают у больных острыми лимфобластными лейкозами и иногда у больных острыми миелоидными лейкозами), а также мутаций гена MYC.
Перед бластным кризом может происходить метилирование ДНК в локусе гена BCR-ABL1.
Есть также сведения об участии в прогрессии хронического миелолейкоза ИЛ-1бета.
Представленные данные свидетельствуют о том, что опухолевая прогрессия обусловлена несколькими механизмами, однако точная роль каждого из них неизвестна.
Клинические проявления заболевания
При развитии ОМЛ наблюдают ряд синдромов:
- гиперпластический;
- геморрагический;
- анемический;
- интоксикацию и нейролейкоз;
- лейкостазы.
Они проявляются в виде типичной симптоматики, свидетельствующей о системном поражении всего организма. Для общей картины заболевания характерны постоянная усталость, плохой аппетит, бледность кожных покровов. Могут быть спонтанные скачки температуры, которые вначале принимают за проявления обычной простуды. В начале болезни увеличения лимфоузлов не наблюдают. Иногда возникают болезненные ощущения в ногах при ходьбе, которые поначалу проходят. Острый миелоидный лейкоз развивается постепенно, поэтому его симптомы появляются не сразу. Распознать заболевание в начальной стадии можно на основании развёрнутого анализа крови. Далеко не все пациенты подозревают у себя опасную болезнь, а тревожные симптомы часто списывают на усталость и переутомление.
На поздних стадиях ОМЛ возникают тяжёлая форма интоксикации, лейкостазы и нейролейкоз.
Гиперпластический синдром
Когда недозрелые клетки с током крови разносятся по организму, в органах человека возникает инфильтрация тканей. У больного появляются следующие признаки:
- увеличение периферических лимфоузлов, нёбных миндалин;
- увеличение селезёнки (спленомегалия);
- ощущение тяжести в области печени и её увеличение;
- отёчность верхних и нижних конечностей, лица;
- боли в мышцах, костях и суставах.
Отёки появляются вследствие разрастания средостенных лимфатических узлов. Увеличенные лимфоузлы сдавливают область верхней полой вены, и происходит нарушение кровообращения. Шея отекает, лицо приобретает синеватый оттенок, больному трудно дышать. В тяжёлых случаях возникает стоматит Венсана. Его симптомы: отёчность дёсен, боль, трудности при приёме пищи.
Геморрагический синдром
Незрелые миелобласты мешают выработке других кровяных клеток – в том числе и тромбоцитов. В результате этого возникает геморрагический синдром. Он выражается в типичных симптомах:
- истончение сосудистых стенок;
- кровотечения из носа и под кожей, образование множественных гематом на теле;
- кровь идёт долго, её трудно остановить;
- постоянно кровоточат дёсна.
Гематомы на теле появляются даже при незначительном надавливании на кожу. При геморрагическом синдроме высок риск кровоизлияния в мозг.
Анемический синдром
Для анемического синдрома характерны:
- сильная слабость;
- бледность кожных покровов;
- апатичное состояние;
- беспричинные головные боли;
- обмороки;
- головокружения;
- сердечные боли;
- желание есть мел.
Анемические проявления коварны тем, что их легче всего принять за обычное недомогание. Выпадение волос и ломкость ногтей больные часто принимают за недостаток витаминов. Если такое состояние не прекращается, нужно пройти обследование, чтобы заранее исключить злокачественную патологию крови.
Интоксикация и нейролейкоз
При интоксикации возникают:
- быстрая потеря веса;
- снижение аппетита;
- проливной пот;
- высокая температура (37-40С);
- тошнота и рвота;
- понос.
Вследствие снижения иммунитета на поздней стадии ОМЛ присоединяются бронхиты, воспаления лёгких и тяжёлые грибковые поражения слизистых.
Нейролейкозом называют комплекс симптомов, которые возникают при поражении мозга. Пациента мучают сильные головные боли, тошнота и рвота. Могут возникнуть приступы, похожие на эпилептические. При обследовании выявляют стойкое повышение внутричерепного давления. У больного ухудшается слух, нарушается речь, падает острота зрения. При системном поражении мозговых отделов возникают сумеречные состояния и нарушения восприятия окружающего мира.
Лейкостазы
Если при остром миелобластном лейкозе наблюдают общее замедление кровотока (или лейкостаз), прогноз жизни неутешителен. Число незрелых клеток в крови составляет 100 000 1/мкл и больше. Кровь становится густой и вязкой, происходит застой кровообращения во всех органах. Поскольку сосуды больного истончены, риск геморрагического инсульта становится во много раз выше. При лейкостазах высока частота летальных исходов.
Если лейкостаз возникает в малом кругу кровообращения, это чревато не только проблемами с дыханием, но и двусторонней пневмонией. Лечить её непросто, поскольку иммунная система больного подавлена, а содержание кислорода в крови падает с каждым днём. Все инфекционные заболевания, которые присоединяются на поздней стадии ОМЛ, протекают тяжело, с осложнениями, опасными для жизни.
Патогенез (что происходит?) во время Хронического миелоидного лейкоза:
Считается, что ключевую роль в возникновении хронического миелолейкоза играет транслокация t(9;22), приводящая к образованию химерного гена BCR-ABL1. При этом 1-й экзон гена ABL1 замещается различным числом 5′-концевых экзонов гена BCR. Химерные белки Bcr-Abl (один из них — белок p210BCR-ABL1) содержат N-концевые домены Bcr и С-концевые домены Abl1.
Способность химерных белков вызывать опухолевую трансформацию нормальных стволовых кроветворных клеток продемонстрирована in vitro.
Об онкогенности белка p210BCR-ABL1 свидетельствуют также эксперименты на мышах, получивших летальную дозу облучения. Когда им трансплантировали клетки костного мозга, которые были заражены несущим ген BCR-ABL1 ретровирусом, у половины мышей развивался миелопролиферагавный синдром, напоминавший хронический миелолейкоз.
Другие доказательства роли белка p210BCR-ABL1 в развитии хронического миелолейкоза следуют из экспериментов с антисмысловыми олигонуклеотидами, комплементарными транскрипту гена BCR-ABL1. Показано, что эти олигонуклеотиды подавляют рост колоний опухолевых клеток, при этом нормальные гранулоцитарные и макрофагальные колонии продолжают расти.
Слияние гена BCR с геном ABL1 приводит к тому, что увеличивается тирозинкиназная активность белка Abl1, ослабевает его способность связываться с ДНК, а связывание с актином усиливается.
В то же время детальный механизм перерождения нормальных клеток костного мозга в опухолевые неизвестен.
Механизм перехода заболевания от развернутой стадии к бластному кризу тоже неясен. Опухолевому клону присуща ломкость хромосом: помимо транслокации t(9;22) в опухолевых клетках могут появиться трисомия по 8-й хромосоме, делеция в 17р. Накопление мутаций приводит к изменению свойств опухолевых клеток. По данным одних исследователей, скорость развития бластного криза зависит от локализации точки разрыва гена BCR. Другие исследователи эти данные опровергают.
У ряда больных развитию бластного криза сопутствуют разнообразные мутации гена TP53 и гена RB1. Изредка встречаются мутации генов RAS. Есть единичные сообщения о появлении у больных хроническим миелолейкозом белка p190BCR-ABL1 (его часто обнаруживают у больных острыми лимфобластными лейкозами и иногда у больных острыми миелоидными лейкозами), а также мутаций гена MYC.
Перед бластным кризом может происходить метилирование ДНК в локусе гена BCR-ABL1.
Есть также сведения об участии в прогрессии хронического миелолейкоза ИЛ-1бета.
Представленные данные свидетельствуют о том, что опухолевая прогрессия обусловлена несколькими механизмами, однако точная роль каждого из них неизвестна.
Прогноз жизни при остром миелоидном лейкозе
Как правило, врачи довольно осторожны в формулировке прогноза жизни при остром миелоидном лейкозе. Он во многом зависит от возраста больного, наличия и тяжести сопутствующих патологий, индивидуальной реакции на лечение, а также стадии, на которой установлен диагноз и назначена адекватная терапия.
В целом тенденции следующие:
- у детей и молодых людей добиться ремиссии проще, чем у пожилых пациентов. К тому же, она бывает более длительной;
- дети переносят заболевание легче и реагируют на лечение более эффективно;
- прогноз при остром миелоидном лейкозе на выживаемость и приемлемое качество жизни у детей составляет порядка 40-50%, в то время как у взрослых этот показатель находится в пределах всего 20-40%;
- пятилетняя выживаемость пациентов, прошедших полный курс лечения и не осложненных хроническими заболеваниями, составляет по статистике 70-75%;
- рецидивы в течение первых 5 лет после лечения случаются примерно у 30% больных с диагнозом ОМЛ.
Особая группа пациентов – это больные с генетическими мутациями 3, 5 и 7 хромосом. Подобные отклонения значительно осложняют лечение острой миелоидной лейкемии и снижают прогноз выживаемости до 15%, при этом повышая вероятность рецидива до 80%.
Хронический миелолейкоз
– распространённой вид лейкоза, на его долю приходится около 20% всех лейкозов. В странах Европы и Северной Америки ХМЛ занимает 3-е место по частоте после острых лейкозов и хронического лимфолейкоза. Ежегодная заболеваемость составляет 1-1,5 случая на 100000 населения. Пик заболеваемости приходится на возраст 30-50 лет, около 30% составляют больные старше 60 лет.
ХМЛ возникает вследствие соматической мутации в гемопоэтической стволовой клетке, результатом которой является уникальная цитогенетическая поломка — транслокация t(9;22)(q34;q11) с удлинением длинного плеча одной из хромосом 9 и укорочением одной из хромосом 22. Укороченная хромосома 22 называется филадельфийской и обозначается как Ph-хромосома. Для установления диагноза ХМЛ обязательным диагностическим методом является цитогенетическое исследование крови и/или костного мозга.
В течении ХМЛ выделяют три фазы: 1. хроническую, 2. продвинутую, или фазу акселерации, 3. острую, или терминальную (бластный криз). Продолжительность фаз болезни у разных пациентов различается, ХМЛ может быть впервые диагностирована в любой из них.
Хроническая фаза характеризуется постепенно нарастающим лейкоцитозом – 15-20 х109/л в начале заболевания, иногда до 500-900 х109/л и более при развернутой клинической картине. Одновременно в крови появляются незрелые гранулоциты: миелоциты, метамиелоциты, иногда – промиелоциты, даже единичные бластные клетки. Характерно увеличение числа базофилов до 5-10% и нередко одновременно эозинофилов – эозинофильно-базофильная ассоциация. В большинстве случаев отмечается увеличение количества тромбоцитов. В начале заболевание может протекать почти бессимптомно, через несколько месяцев при осмотре обнаруживается увеличение селезенки, которая без лечения достигает огромных размеров. В таких случаях в ней часто бывают инфаркты, которые сопровождаются выраженным болевым синдромом (острой болью). При выраженной спленомегалии может быть увеличена печень.
Терминальная фаза у 80-85% больных характеризуется развитием бластного криза – появление в крови и костном мозге более 20% бластных клеток. Число лейкоцитов при этом может и не повышаться по сравнению с предыдущей фазой. Как правило, в этой фазе развивается не отмечавшаяся на предыдущих этапах анемия, зачастую одновременно и тромбоцитопения. У большинства больных появляются жалобы на повышение температуры тела, ноющую боль в костях, быстрое увеличение селезенки в размерах.
Цель современной терапии ХМЛ – максимальное подавление Ph-позитивного опухолевого клона. Стандартом в настоящее время является терапия ингибиторами BCR-ABL-тирозинкиназ (ИТК). Препараты из группы ИТК обладают механизмом таргетного действия на Ph-позитивные лейкемические клетки. В настоящее время в клинической практике доступны несколько препаратов (иматиниб, дазатиниб, нилотиниб). Для каждого конкретного пациента терапия может быть выбрана с учетом наибольшей эффективности и наименьшей токсичности. Терапия одним из ингибиторов тирозинкиназ должна быть начата сразу после подтверждения диагноза ХМЛ. Лечение может проводиться в амбулаторных условиях. Прием ИТК можно начинать при любом числе лейкоцитов. После начала приема ИТК число лейкоцитов начинает снижаться через 1-2 недели и нормализуется к 4-6 неделям. Уменьшение повышенного числа тромбоцитов обычно отстает на 1-2 недели. При лечении больных в хронической фазе ХМЛ при снижении числа гранулоцитов менее 1,0х109/л или тромбоцитов менее 50х109/л рекомендуется сделать перерыв в лечении и возобновить его при увеличении количества гранулоцитов до 1,5х109/л, тромбоцитов до 100х109/л.
Для правильной оценки эффективности терапии ингибиторами тирозинкиназ рекомендуется цитогенетическое исследование каждые 6 мес. После достижения полной цитогенетической ремиссии рекомендуется на протяжении всего заболевания каждые 3 мес. проводить молекулярное исследование на наличие BCR-ABL-транскрипта с помощью ПЦР в реальном времени.