Какие компоненты крови образуют иммунитет
Содержание:
- Иммунная система
- Виды иммунитета
- Укрепление иммунитета
- Что такое врожденный иммунитет?
- «Из всех микроорганизмов, которые живут в человеке, совсем немногие оказываются «вредителями»
- Органы и клетки иммунной системы
- Ожирение и диета способны помогать раку
- Старики с высоким разнообразием TCR
- Печень и костный мозг
- Чем опасно снижение иммунитета
- Система комплемента
- Особые участки
- Макрофаги
- Лимфоциты В
- Тимус — военная база иммунной системы
- Как работает иммунитет
Иммунная система
Иммунная система — это защитные механизмы и реакции по предоставлению организму устойчивости и сопротивляемости к негативным факторам внешней и внутренней среды.

Иммунитет представлен рядом органов, которые синтезируют, распространяют и влияют на функционирование иммунокомпетентных клеток:
- Периферических — печень, селезенка, лимфатические узлы, миндалины;
- Центральных — вилочковая железа, тимус.
Иммунная система подразделяется на виды:
- Врожденный — наличие генетически обусловленной защиты;
- Приобретенной — развитие и усовершенствование механизмов и реакций.
Так как иммунитет выполняется на двух уровнях — гуморальном и клеточном, то можно выделить специфические и неспецифические виды защиты, которые зависят от вида иммунитета.
Так же совокупность деятельности врожденного и адаптационного иммунитетов определяет быстроту и эффективность наступления иммунного ответа.
Иммунный ответ — это реакция защитной системы на проникновение чужеродного объекта или изменение собственных клеток организма. Он состоит из двух циклов:
- Поиск и распознавание чужеродного гена;
- Координация всех иммунокомпетентных клеток на обезвреживание и уничтожение патогена.
При этом иммунитет имеет функции по запоминанию, то есть клетки естественно приобретенного вида способны формировать иммунологическую память для более эффективного и быстрого иммунного ответа на повторное заражение возбудителем.

Виды иммунитета
1) И вот теперь, когда мы узнали, что такое иммунная система, что она состоит из центральных и периферических органов, из различных клеток, теперь мы узнаем про виды иммунитета:
- клеточный иммунитет
- гуморальный иммунитет.
Эта градация очень важна для понимания любому врачу. Так как многие лекарственные препараты действуют либо на один, либо на другой вид иммунитета.
Клеточный представлен клетками: Т-киллеры, Т-хелперы, макрофаги, нейтрофилы и т.д.
Гуморальный иммунитет представлен антителами и их источником – В-лимфоцитами.
2) Вторая классификация видов – по степени специфичности:
— неспецифический (или врожденный) – например, работа нейтрофилов в любой реакции воспаления с образованием гнойного отделяемого,
— специфический (приобретенный) – например, выработка антител к вирусу папилломы человека, или к вирусу гриппа.
3) Третья классификация – виды иммунитета, связанные с медицинской деятельностью человека:
— естественный – появившийся в результате болезни человека, например, иммунитет после ветрянки,
— искусственный – появившийся в результате прививок, то есть введения ослабленного микроорганизма в организм человека, в ответ на это в организме вырабатывается иммунитет.
Укрепление иммунитета
Восстановление иммунитета и профилактика его ухудшения проводятся с соблюдением одних и тех же правил:
- Качественное, сбалансированное питание (при необходимости дополнительно принимают витаминные комплексы, но только после консультации с врачом!).
- Умеренная физическая активность: плавание, бег, ходьба, гимнастика, фитнес.
- Повышение стрессоустойчивости.
Справка! Укрепление иммунитета у взрослых подразумевает также отказ от вредных привычек: курения, частого употребления спиртного.
Чаще всего вредоносные бактерии и вирусы попадают в организм через нос, полость рта, желудок и кожу. Поэтому необходимо тщательно соблюдать личную гигиену – это также позволит укрепить иммунитет. Регулярно посещайте стоматолога, не допускайте развития патологий зубов и десен!
Стимулировать работу иммунной системы помогают специальные препараты – иммуномодуляторы. Однако принимать решение о целесообразности их приема (как и выбирать средства) должен врач.
Если у вас наблюдаются признаки ослабления иммунитета, запишитесь на прием к врачу-иммунологу Поликлиники Отрадное! Опытные врачи проведут необходимые исследования, выявят нарушения и назначат необходимое лечение. Также вы можете прийти на консультацию, даже если у вас нет тревожных симптомов, и провести вакцинацию качественными препаратами.
Что такое врожденный иммунитет?
По-другому его ещё называют естественный. Такой иммунитет у человека с рождения, и ему не нужен опыт предыдущего столкновения с возбудителем. Его антигены одинаково влияют на все чужеродные организмы. Он формируется очень долго в отличие от приобретённого. Его изменения происходят на уровне эволюции, со свойствами определенного организма. Так же обуславливается видовой невосприимчивостью.
Существуют два типа врожденного иммунитета;
- Гуморальный – к нему относиться: кожные покровы, лимфатическая система, слизистые оболочки, органы защитной системы (селезенка, аппендикс).
- Клеточный – к нему относятся лимфоциты и другие кровяные тельца.
Отличие клеточного от гуморального иммунитета в том, что разные объекты воздействия на него. Клеточный функционирует в клетках организма, предотвращая размножение инородных микроорганизмов. Гуморальный влияет вне клеточного пространства и уже оказывает действия непосредственно на бактерии и вирусы. Однако они очень плотно взаимосвязаны и один без другого существовать не может.
«Из всех микроорганизмов, которые живут в человеке, совсем немногие оказываются «вредителями»
— Какие вирусы обычно живут в теле человека? Почему они не наносят ему особого вреда?
— Во-первых, действительно, в нашем организме живут вирусы, заселившие его в процессе жизни человека — например, всем известный вирус герпеса или менее известный вирус Эпштейна-Барра. Вообще, человек — это суперорганизм, который населен не только вирусами, но и огромным количеством бактерий. Весь кишечник населен бактериями, которые во многом являются сапрофитами и работают на благо организма. Бактерии и вирусы живут в бронхолегочных структурах, на коже, слизистых оболочках. То есть существует определенный симбиоз человека и бактерий, вирусы также принимают в этом участие.
Второй момент: в течение эволюции много миллионов лет назад в геном млекопитающих встроились гены ретровирусов (аналогичных чем-то современному вирусу СПИДа) и начали продуцировать ряд белков иммунной системы, то есть вирусы стали «антивирусами», если говорить компьютерным языком. Это эволюционная биология действительно вызывает удивление, но это так: мы — суперорганизм.
— Вирусы проникают в ребенка, когда он находится в утробе матери?
— Не только вирус, но и целый ряд даже крупных бактерий могут проникать транспланцентарно. На этом было основано лечение детского туберкулеза. Знаменитая прививка вакциной БЦЖ возникла потому, что заражение младенцев внутриутробно или в момент родов от больных матерей создавало огромную проблему. Младенцы гибли от тяжелых форм туберкулеза. Микробактерия туберкулеза по сравнению с вирусом — это динозавр по сравнению с мышкой. Поэтому, конечно, вирус и подавно проходит через целый ряд биологических барьеров, это нормально.
Фото yandex.ru
— Почему же вирусы не наносят особого вреда ребенку в утробе?
— Существует специализированная система иммунитета. Это подвижные клетки — лимфоциты и макрофаги, которые взаимодействуют со всеми пришельцами и каким-либо образом ограничивают их активность. Из всех микроорганизмов, которые живут в человеке, совсем немногие оказываются «вредителями». Для этого должны возникнуть какие-то специфические условия, когда иммунная система позволяет развиваться патогенным возбудителям.
Система иммунитета, если упростить наш рассказ о ней, дуалистична. Есть врожденный иммунитет, который имеется у новорожденного и присущ ему вне зависимости от контакта с окружающей средой. А есть приобретенный иммунитет, который развивается уже в процессе контакта организма с окружающей средой. Они оба работают для того, чтобы организм выжил. Часть иммунных клеток относится к врожденному иммунитету, другая часть — к приобретенному.
— Кстати, врожденный иммунитет различается у людей с разных континентов?
— Врожденный иммунитет — это тоже сложная система. Клетки, принадлежащие ей, имеют рецепторы, распознающие так называемые «образы патогенности» — это эволюционно консервативные белки, присущие огромному количеству видов и типов различных микроорганизмов. И врожденный иммунитет реагирует именно на них. То есть это система «ковровых бомбардировок», она не является строго специфичной, действующей против конкретного вируса или конкретной бактерии. Судя по существующим исследованиям, эти «образы патогенности» одинаковы у многих микроорганизмов, где бы они ни существовали.
А приобретенный иммунитет гораздо более специфичная система, которая имеет и расовые, и региональные, и индивидуальные особенности.
Органы и клетки иммунной системы
Остановимся здесь кратко, так как это сугубо медицинская информация, ненужная простому человеку.
Красный костный мозг, селезенка и тимус (или вилочковая железа) – центральные органы иммунной системы. Лимфатические узлы и лимфоидная ткань в других органах (например, в миндалинах, в аппендиксе) – это периферические органы иммунной системы.
Запомните: миндалины и аппендикс – НЕ ненужные органы, а очень даже важные органы в организме человека.
Основная задача органов иммунной системы человека – выработка различных клеток.
Какие бывают клетки иммунной системы?
1) Т-лимфоциты. Делятся на различные клетки – Т-киллеры (убивают микроорганизмов), Т-хелперы (помогают распознавать и убивать микробов) и другие виды.
2) В-лимфоциты. Главная их задача – выработка антител. Это вещества, которые связываются с белками микроорганизмов (антигены, то есть инородные гены), инактивируют их и выводятся из организма человека, тем самым «убивая» инфекцию внутри человека.
3) Нейтрофилы. Эти клетки пожирают инородную клетку, разрушают ее, при этом также разрушаясь. В итоге появляется гнойное отделяемое. Характерный пример работы нейтрофилов – воспаленная рана на коже с гнойным отделяемым.
4) Макрофаги. Эти клетки также пожирают микробов, но сами не разрушаются, а уничтожают их в себе, либо передают на распознавание Т-хелперам.
5)Эозинофилы. Вырабатывают вещества, которые разрушают паразитов в организме человека. Характерное проявление работы эозинофилов – аллергическая реакция на гельминтов (на глисты).
Есть еще несколько клеток, которые выполняют узкоспециализированные функции. Но они интересны специалистам-ученым, а простому человеку достаточно тех видов, что указаны выше.
Ожирение и диета способны помогать раку
В новом исследовании на мышах ученые Гарвардской Медицинской школы обнаружили новый фрагмент этой головоломки, с огромными последствиями для иммунотерапии рака: ожирение позволяет раковым клеткам превзойти убивающие опухоль иммунные клетки CD8+ в битве за энергию.
В своих выводах исследовательская группа показывает, что диета с повышенным содержанием жиров снижает количество и противоопухолевую активность иммунных CD8+ Т-клеток. Эти клетки, являясь частью иммунной системы, считаются критически важными для сдерживания роста злокачественных опухолей. И эти CD8+ клетки проникают внутрь опухолей для подавления рака.
Как показали эксперименты, при диете с повышенным содержанием жиров раковые клетки перепрограммируют свой метаболизм в ответ на повышенную доступность жира, чтобы лучше поглощать богатые энергией жиры, лишая иммунные Т-клетки топлива и ускоряя рост опухоли.
“Формирование одной и той же опухоли в условиях ожирения и при его отсутствии показывает, что раковые клетки перестраивают свой метаболизм в ответ на диету с высоким содержанием жиров“, – отметила Марсия Хейгис, профессор клеточной биологии в Институте Блаватника, соавтор исследования. “Наше открытие показывает, что противораковая терапия, которая потенциально будет работать в одной ситуации, может быть не столь эффективной в другой, и это необходимо лучше понять, учитывая эпидемию ожирения в нашем обществе.”
Изменение активности иммунных CD8+ T-клеток в зависимости от ожирения и количества жира в диете
Команда ученых обнаружила, что блокирование, связанного с жиром метаболического перепрограммирования раковых клеток, значительно уменьшило объем опухоли у мышей, которые находились на диете с большим количеством жира в питании. CD8+ Т-клетки являются основным оружием современной иммунотерапии, которая активирует иммунную систему против рака, поэтому результаты этого исследования предполагают новые стратегии улучшения такой терапии.
“Иммунотерапия рака оказывает огромное влияние на жизнь пациентов, но она не приносит пользы всем“, – сказала другой соавтор исследования Арлин Шарп, профессор сравнительной патологии и заведующая кафедрой иммунологии Института Блаватника им.Джорджа Фабиана. “Теперь мы знаем, что существует метаболическое перетягивание каната между иммунными Т-клетками и опухолевыми клетками, которое меняется с ожирением“.
Ученые изучали влияние ожирения на мышиные модели различных типов рака, включая колоректальный рак, рак молочной железы, меланому и рак легких. Команда давала мышам нормальную пищу или с большим количеством жира, что приводило к увеличению массы тела и другим изменениям, связанным с ожирением. Затем они изучили различные типы клеток и молекул внутри и вокруг опухолей, которые вместе называются микроокружением опухоли.
Иммунные CD8+ Т-клетки в микроокружении опухоли (источник)
Старики с высоким разнообразием TCR
Исследователи сравнивали Т-клеточные профили периферической крови людей из четырех возрастных групп. Удивительным оказалось то, что люди в возрасте 71–90 лет обладали большим разнообразием TCR и большим процентным содержанием наивных Т-клеток в пуле CD4+, чем люди возрастной категории 61–66 лет. Возможным объяснением такого отклонения от линейной зависимости стало предположение о восстановлении утраченных функций тимуса вследствие прекращения выработки половых гормонов в пожилом возрасте. Считается, что наиболее заметный спад активности тимуса происходит во время пубертатного периода, когда организм резко начинает вырабатывать большие количества половых гормонов. Вероятно, это связано с перераспределением ресурсов: приоритет в этом возрасте отдаётся развитию половой системы, а процесс созревания наивных Т-клеток в тимусе довольно энергозатратен. Смысл столь ранней инволюции органа может заключаться и в том, что в юном возрасте тимус состоит из молодых тканей, в структуре которых ещё нет дефектов, повышающих вероятность проникновения чужеродных агентов внутрь органа и использование их клетками тимуса для презентации созревающим наивным Т-клеткам как собственных антигенов, экспрессируемых организмом .
Другое объяснение явления увеличения разнообразия TCR после 70 лет заключается в том, что люди этой возрастной группы уже перешагнули определённый возрастной порог, пройдя в некотором смысле проверку на прочность — уникальный набор физиологических параметров, включая особенности иммунной системы, сделал их наиболее приспособленными среди всех особей популяции в данных условиях. Из этого можно заключить, что повышенное содержание наивных Т-клеток в субпопуляции CD4+ периферической крови человека коррелирует с долгожительством. Увеличение доли наивных Т-клеток в пуле CD4+, а значит и увеличение разнообразия TCR обеспечивает лучшую иммунорегуляторную функцию, что снижает общее воспаление, усиливающееся по мере старения организма из-за активации аутоиммунных процессов, увеличивает эффективность распознавания раковых клеток и обеспечивает более сбалансированный иммунный ответ .
Печень и костный мозг
Дефинитивные ЭГСК могут генерировать полный набор линий эритроидных, миелоидных, лимфоидных клеток и мегакариоцитов в печени плода, однако нейтрофилы будут отсутствовать до установления гемопоэза в костном мозге (КМ) . В отличие от макрофагов, моноциты и дендритные клетки (ДК) считаются ЭГСК-зависимыми популяциями. У мышей они прослеживаются вплоть до клоногенного предшественника в КМ, называемого предшественником ДК-макрофагов . В процессе человеческого эмбриогенеза первые признаки пролиферации ДК наблюдаются в печени плода уже примерно с 6 недели ВУР . Обычные ДК1, ДК2 и плазмоцитоидные ДК обнаруживаются в тканях плода — включая легкие, селезенку, кожу и тимус — на 12 недели ВУР и являются относительно многочисленными по сравнению с популяцией ДК во взрослых тканях . ДК плода, как и их аналоги во взрослом организме, способны мигрировать, реагировать на Toll-подобные рецепторы и стимулировать пролиферацию и активацию T-клеток . Фетальные ДК обладают особой способностью индуцировать дифференцировку регуляторных Т-лимфоцитов, стимулировать выработку Т-клеточного интерлейкина 4 и ингибировать выработку фактора некроза опухоли альфа (TNF-α) с помощью аргиназы II . Таким образом, ДК играют важную роль в поддержании толерантности во время ВУР. Популяция В-клеток впервые появляется в печени плода с 7 недели ВУР в виде предшественников В-лимфоцитов; зрелые же B-клетки присутствуют только после 9 недели ВУР .
Частично это можно объяснить изменением способности ЭГСК продуцировать B-клетки и соответствующего микроокружения печени, необходимого для их дифференцировки . В середине беременности КМ становится основным источником B-клеток, а зрелые B-клетки в изобилии обнаруживаются в селезенке . И хотя разнообразие эмбриональных В-лимфоцитов достигается еще на ранних стадиях , формирование герминативных центров подавляется до воздействия антигенов после рождения, что сопровождается активной соматической гипермутацией . Сравнение В-клеток кишечника, полученных от плодов второго триместра, с В-клетками младенцев при помощи масс-цитометрии, комбинированной с анализом репертуара рецепторов В-клеток, хорошо продемонстрировало, что кишечные В-клетки у плода — это, прежде всего, фолликулярные и переходные В-клетки, тогда как плазматические В-клетки в большей степени представлены у младенцев . Другим интересным аспектом дифференцировки В-клеток, который интенсивно изучался на мышиной модели, является поэтапное развитие клеток В-1, сходных с клетками врожденного иммунитета. Они преобладают в начале беременности, а затем появляются и обычные клетки В-2 . Однако окончательно идентичность человеческих B-1-подобных клеток еще не определена . Будущие исследования по созданию клеточного атласа КМ и селезенки плода человека позволят лучше понять онтологию B-клеток, подчеркнув специфические для тех или иных органов различия в нишевых факторах, которые поддерживают дифференцировку B-клеток.
Чем опасно снижение иммунитета
Если понижается иммунная активность, организм подвержен различным заболеваниям. В тяжелых случаях иммунодефицита возможен летальный исход. Последствия слабой иммунной защиты:
- глистные инвазии;
- ОРВИ, грипп и прочие заболевания, вызванные вирусами;
- системные и кожные грибковые патологии (микозы, дерматозы, кандидозы).
Заболевания иммунной системы
Болезни делятся по типу нарушения immunitas. При чрезмерном иммунном ответе развиваются аллергии, при недостаточном – иммунодефициты, при атипичном перерождении клеток – аутоиммунные патологии. Распространенные заболевания:
- Аллергия. Возникает на продукты питания, латекс, пыльцу, перья птиц, шерсть животных, бытовую химию.
- Иммунодефициты. Связаны с дефектами иммунного ответа. Распространенные патологии: СПИД, цитомегаловирус, вирус Эпштейна–Барра.
- Аутоиммунные болезни. Реакция уничтожения направлена на собственные клетки. В результате возникают такие патологии, как красная волчанка, рассеянный склероз, болезнь Крона.
Система комплемента
Система комплемента, как и антитела, представляет собой ряд защитных реакций белков в комплексе, которые находятся в крови.
В нашем кровотоке есть миллионы различных антител, каждое из которых чувствительно к определенному антигену. Система комплемента представляет собой сеть белков (50 видов) сыворотки крови. Из них 9 белков осуществляют основные функции каскада. Сначала обнаруживается чужеродный агент, затем к нему прикрепляется один из белков комплимента.
Далее он последовательно взаимодействует с другими белками системы. Эти белки, взаимодействуя между собой, расщепляются на фрагменты и создают молекулярные комплексы (сигнальные молекулы), которые вызывают воспаление и тем самым привлекают иммунные клетки в инфицированный очаг.
Так очень упрощенно описана работа система комплимента. На самом деле, это очень сложный процесс. Может пойти что-то не так, и запустится аутоиммунный процесс. Но это работа ученых и медиков. Нам лишь нужно понять механизм.
Особые участки
Иммунологи Центра гематологии также описали участки спайк-белка SARS-CoV-2, которые вызывают наиболее сильный иммунный ответ у переболевших COVID-19. Встретившись с этим белком, защитная система человека «запоминает» вирус, и, если он попадет в организм, сможет его обезвредить.
Тело без антитела
Фото: ИЗВЕСТИЯ/Зураб Джавахадзе
Оказалось, что два участка вируса распознаются иммунной системой большинства людей-носителей самого распространенного в Европе варианта гена HLA-A, отвечающего за демонстрацию фрагментов вирусов Т-лимфоцитам. Оба выявленных фрагмента уникальны для нового SARS-CoV-2, то есть отличают его от других коронавирусов. Значит, их можно использовать, чтобы выделять людей, переболевших именно COVID-19.
— Нужно понимать, что Т-лимфоциты распознают вирус не целиком, а его короткие фрагменты. И у разных людей в силу генетических особенностей эти фрагменты разные, — сообщил «Известиям» заведующий лабораторией трансплантационной иммунологии в НМИЦ гематологии Минздрава России Григорий Ефимов. — Выходит, что вирусу не так просто уйти от иммунной системы, ведь он мог бы внести мутации в распознаваемые участки и тем самым стать невидимым для Т-лимфоцитов. Но это сложно, так как такие мутации против одного человека будут эффективны, а для других нет.
Понимание того, какие именно фрагменты вируса распознает иммунитет большинства людей, поможет определить, насколько эффективны вакцины и содержат ли они именно эти уникальные участки. Также это позволит создать максимально эффективные тест-системы, которые будут показывать уровень Т-лимфоцитов, и указывать именно на SARS-CoV-2, а не какой-либо другой коронавирус.
Макрофаги
Это также белые кровяные клетки, проходящие по кровяному руслу, но при необходимости способные проникать в ткани. Некоторые органы (почки, печень, кожа и легкие) имеют свои «постоянные» макрофаги. Такие фиксированные макрофаги специализируются по отношению к тем бактериям, которые обычно проникают в организм в местах их постоянного пребывания.
Макрофагов в крови намного меньше, чем гранулоцитов – около 100000 по сравнению с 10000000 гранулоцитов на 1 мл крови.
Макрофаги располагают рецепторами – антеннами, благодаря которым получают информацию о микробной клетке и включается в программу нейтрализации чужеродного микроорганизма.
Активные макрофаги начинают вырабатывать целый спектр химических средств борьбы с бактериями, вирусами и раковыми клетками. Эти вещества буквально испепеляют вражескую клетку.
Микроорганизмы под влиянием окислителей-макрофагов распадаются и погибают.
Пока неизвестно, какой механизм лежит в основе распознавания вирусов или раковых клеток. Нередко раковая опухоль своевременно не распознается, остается как бы не замеченной иммунной системой. Иногда и вирусы не замечаются макрофагами. Задача современных исследований заключается в своевременном распознавании вирусных клеток, раковых клеток, создании новых лекарственных средств, убивающих раковые клетки и опасные вирусы до того, как они смогут причинить организму большой вред.
Сразу после распознавания вируса или раковой клетки макрофаг выделяет в кровь цитокины. Эти вещества вызывают в организме самые разные реакции, в том числе лихорадку, сон.
Макрофаги поставляют информацию Т-лимфоцитам, которые стимулируют мощный иммунный ответ. Т-лимфоциты включают в себя два типа иммунных клеток, каждый из которых способен ввести в действие различные компоненты иммунной системы.
Последовательно рассмотрим их.
Лимфоциты В
Лимфоцитные клетки, синтезирующиеся в красном костном мозге и мигрирующие в селезенку и лимфатическую систему для дальнейшего формирования посредством контакта с антигенами или лимфоцитами типа Т непосредственно участвующие в формировании гуморального иммунитета — это лимфоциты типа В. До момента полной формировки, В клетки находятся в виде «наивных» тел, не контактировавших с чужеродным геном или клетками Т. После окончательного формирования они приобретают вид:
- Плазматических телец, функции которых направлены на продуцирование антител, благодаря тому, что у них развивается сеть эндоплазмотического характера, а так же приобретается комплекс Гольджи. В крови повышенный уровень плазматических клеток держится до полного уничтожения и выведения патогена;
- Клеток памяти иммунитета — это небольшой процент лимфоцитных тел типа В, которые взаимодействовали с Т клетками. После чего, «наивные» В клетки изменяются в своем строении и биохимическом составе, вследствие чего сохраняют полученную информацию о возбудителе болезни.
Для клеток лимфоцитарного типа В характерно наличие на их поверхности мембраносвязанных антител в виде иммуноглобулинов М, Д и поверхностных активных веществ, что и образует комплекс, способный распознавать чужеродные частицы.
Так же рассматривается типизация лимфоцитов В по классам:
- Класс В1 — обеспечивает продуцирование антител в виде белковых иммуноглобулиновых соединений М, что отвечает за образование иммунного ответа на недавно внедрившегося в организм чужегенного объекта, который смог пройти первую линию обороны местного иммунитета;
- Класс В2 — способны формировать антитела в виде иммуноглобулинов G, вследствие того, что инфицирование произошло довольно успешно и патоген начал свое распространение по организму.
Тимус — военная база иммунной системы
В тимусе иммунная система обучает своих «солдат». Предшественники Т-лимфоцитов размножаются в костном мозге и с кровью попадают в тимус. В нём происходит ключевое событие в жизни Т-клеток, определяющее их специфичность к антигену, с которым они никогда ещё не встречались — соматическая рекомбинация (также V(D)J-рекомбинация, рис. 2). Она заключается в перетасовке участков генов, кодирующих гипервариабельные участки α и β цепей Т-клеточного рецептора (TCR). С помощью TCR Т-клетки распознают «свой» антиген, к которому они специфичны, в составе главного комплекса гистосовместимости (MHC) антиген-презентирующих клеток (рис. 3). Благодаря этому процессу создаётся гигантское разнообразие TCR — около 6 × 105 возможных вариантов на каждые 106 Т-клеток . В силу такой огромной вариабельности Т-клеточных рецепторов существует высокая вероятность того, что при проникновении в организм какого-либо чужеродного агента найдётся Т-клетка, TCR которой окажется специфичным именно ему. Соматическая рекомбинация происходит в кортикальной части тимуса, из неё клетки мигрируют в медуллярную часть и претерпевают негативный отбор: в экземплярах, реагирующих на собственные антигены, экспрессируемые организмом, запускается апоптоз.
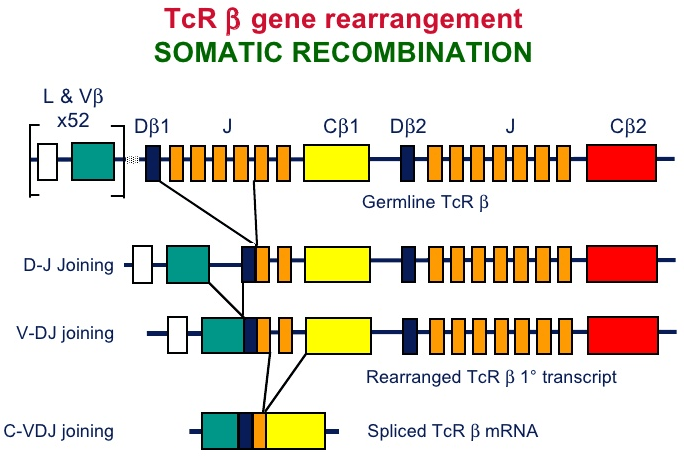
Рисунок 2. Соматическая рекомбинация на примере β цепи TCR. Исходная последовательность в гене, кодирующем β цепь TCR содержит V (variable), D (diversity), J (Joining) и C (constant) сегменты. Сначала один из двух D-сегментов соединятеся с одним из 13 J-сегментов. Получившийся DJ-сегмент присоединяется к одному из 50 V-сегментов. Сегменты выбираются случайным образом, и механизм их сшивки также предполагает случайное варьирование количества пар оснований, это обеспечивает разнообразие TCR. Аналогичный процесс происходит c последовательностью, кодирующей α-цепь только без D-сегмента.
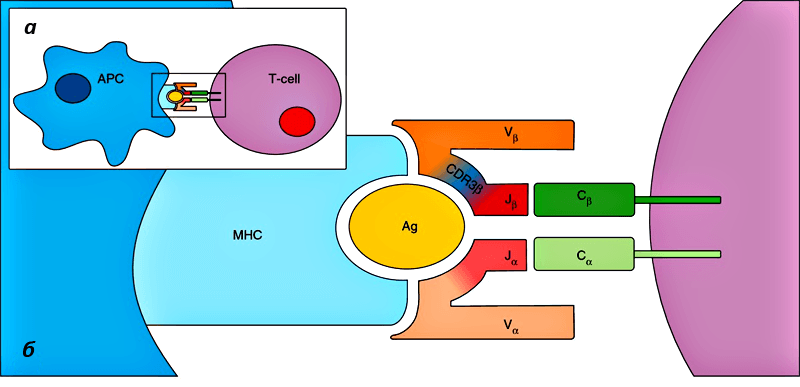
Рисунок 3. Взаимодействие TCR и антиген-презентирующей клетки. а — Т-клетка (фиолетовая) взаимодействует с антиген-презентирующей клеткой (APC, синяя). б — APC презентирует антиген в составе MHC. Гетеродимер TCR состоит из α и β цепей, охватывающих MHC с антигеном. С антигеном главным образом взаимодействуют области CDR3 — это домены, отвечающие за специфичность TCR к данному антигену.
После наступления пубертатного периода производство тимусом наивных Т-клеток резко снижается и на протяжении всей взрослой жизни человека активность этого органа остаётся на самом базальном уровне. Чем это грозит? Созданное за такой короткий период огромное разнообразие TCR действительно обеспечивает эффективный иммунный ответ на большинство потенциальных угроз. Но это разнообразие остаётся константным только некоторое время.
Как работает иммунитет
С детских лет мы знаем, что иммунная система защищает наш организм от проникновения инфекций, микробов, болезнетворных микроорганизмов. Также сюда можно отнести пагубное воздействие внешней среды – холода, жары, ультрафиолетового излучения, простейших гельминтов. Но, мы мало представляем, какова роль иммунной системы внутри человеческого тела. Ее можно вполне обоснованно называть «санитаром», «мусоросборником», без которого существование попросту невозможно.
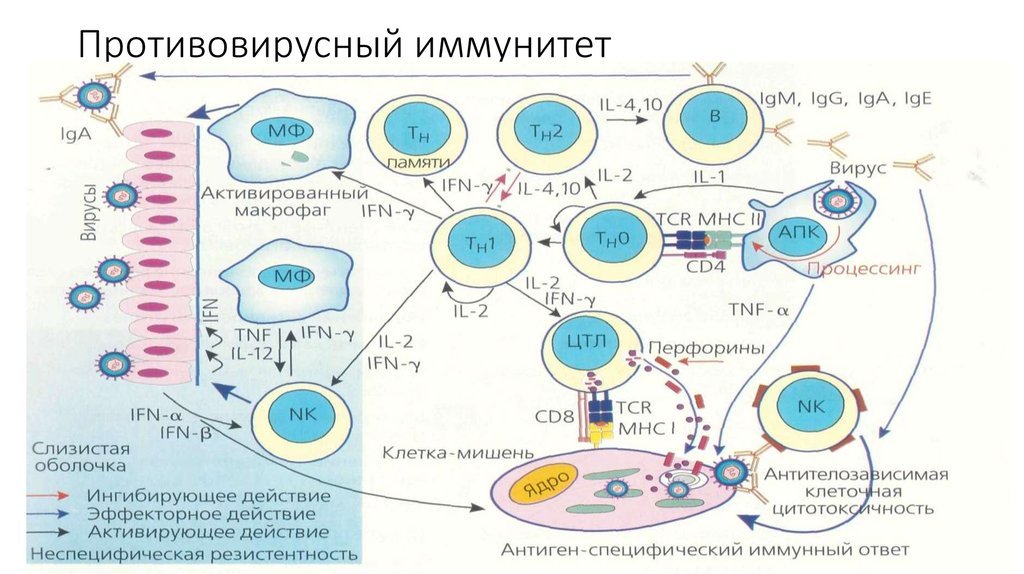
Как работает иммунная система. Фото: en.ppt-online.org
Клетки иммунитета – макрофаги, истребляют возбудителей, собирают остатки жизнедеятельности отмерших клеток, выводят из организма токсины, продукты застоя. За счет этого сохраняется на оптимальном уровне метаболизм, заживают раны, восстанавливаются силы после тяжелых болезней, хирургических операций и т. д.