Открытие антибиотиков
Содержание:
- Краткая история открытия антибиотиков: пенициллина, стрептомицина и остальных
- Терминология
- Великий прорыв
- Вакцины
- Конфликт интересов: врачи хотят быстро, пациенты хотят сразу, фармкомпании и аптеки хотят прибыль, но супербаги диктуют свои правила
- Производство пенициллина в США во время Второй мировой войны
- Эффект от разных препаратов
- Когда использовать антибиотики?
- Группы антибиотиков
- Способы их применения
- Широкий и узкий спектр
- Как антибиотики влияют на печень, почки?
- Продолжение великого дела
- Фаготерапия
- История открытия антибиотиков и их роль на Земле
- Антибиотики: для превращения из незаменимых лекарств в бесполезные потребовалось 100 лет
- Процесс изготовления антибиотиков
- Скорость действия при различных заболеваниях
- Как действуют антибиотики?
Краткая история открытия антибиотиков: пенициллина, стрептомицина и остальных
Врачи и исследователи отмечали низкую эффективность антисептиков в отношении возбудителей, проникших глубоко в ткани. Кроме того, действие лекарств ослаблялось биологическими жидкостями пациента и было коротким. Требовались более действенные препараты, и учёные всего мира активно работали в данном направлении.
В каком веке изобрели антибиотики?
Явление антибиоза (способности одних микроорганизмов уничтожать другие) было открыто в конце 19 столетия.
- В 1887 году один из основоположников современной иммунологии и бактериологии – всемирно известный французский химик и микробиолог Луи Пастер – описал губительное действие почвенных бактерий на возбудителя туберкулёза.
- Опираясь на его исследования, итальянец Бартоломео Гозио в 1896 году получил в ходе экспериментов микофеноловую кислоту, ставшую одним из первых антибактериальных средств.
- Чуть позже (в 1899) немецкие врачи Эммерих и Лов открыли пиоценазу, подавляющую жизнедеятельность возбудителей дифтерии, тифа и холеры.
- А ранее – в 1871 году – российские врачи Полотебнов и Манассеин обнаружили губительное действие плесневых грибов на некоторые болезнетворные бактерии и новые возможности в терапии венерических заболеваний. К сожалению, их идеи, изложенные в совместном труде «Патологическое значение плесени», не обратили на себя должного внимания и на практике широко не применялись.
- В 1894 году И. И. Мечников обосновал практическое использование кисломолочных продуктов, содержащих ацидофильные бактерии, для лечения некоторых кишечных расстройств. Это позднее подтвердили практические исследования русского учёного Э. Гартье.
Тем не менее, эпоха антибиотиков началась в 20 веке с открытия пенициллина, положившего начало настоящей революции в медицине.
Терминология
Полностью синтетические препараты, не имеющие природных аналогов и оказывающие сходное с антибиотиками подавляющее влияние на рост бактерий, традиционно было принято называть не антибиотиками, а антибактериальными химиопрепаратами. В частности, когда из антибактериальных химиопрепаратов известны были только сульфаниламиды, принято было говорить обо всём классе антибактериальных препаратов как об «антибиотиках и сульфаниламидах». Однако в последние десятилетия в связи с изобретением многих весьма сильных антибактериальных химиопрепаратов, в частности фторхинолонов, приближающихся или превышающих по активности «традиционные» антибиотики, понятие «антибиотик» стало размываться и расширяться и теперь часто употребляется не только по отношению к природным и полусинтетическим соединениям, но и ко многим сильным антибактериальным химиопрепаратам.
Великий прорыв
В 1928 году шотландский биолог Александр Флеминг заметил ореол ингибирования роста бактерий на культуре палочек Staphylococcus. Он пришел к выводу, что плесень выпускает вещество, которое ингибирует рост бактерий. Он выращивал чистую культуру плесени и впоследствии синтезировал то, что позже назвал «пенициллин». В течение следующих двенадцати лет Флеминг выращивал и селекционировал оригинальный штамм плесени, которая в конечном итоге была идентифицирована как пенициллийный нотаум (сегодня — как Penicillium chrysogenum). Ему не удалось создать стабильную форму для массового производства. Тем не менее открытие антибиотиков Флемингом положило начало новой эпохи в истории медицины.
Вакцины
Вакцины полагаются на иммунную модуляцию или аугментацию. Вакцинация либо возбуждает, либо усиливает иммунитет человека для предотвращения инфекции, приводя к активации макрофагов, производству антител, воспалению и другим классическим иммунным реакциям. Антибактериальные вакцины ответственны за резкое сокращение глобальных бактериальных заболеваний. Вакцины, полученные из аттенюированных целых клеток или лизатов, были заменены в основном менее реакционноспособными, бесклеточными вакцинами, состоящими из очищенных компонентов, включая капсульные полисахариды и их конъюгаты, белковыми носителями, а также инактивированными токсинами (токсоидами) и белками.
Конфликт интересов: врачи хотят быстро, пациенты хотят сразу, фармкомпании и аптеки хотят прибыль, но супербаги диктуют свои правила
Как только лекарство станет легально доступным, его необходимо презентовать врачам и системам здравоохранения. Однако сегодня фармацевтические фирмы обязаны направлять усилия на то, чтобы специалисты знали о новом лекарстве, но не выписывали антибиотик, пока он не станет крайней мерой.
Это необходимо, чтобы предотвратить появление новой лекарственной устойчивости. Но такой подход серьезно ограничивает прибыльность нового препарата, поэтому антибиотики уже печально известны своей низкой рентабельностью по сравнению с другими лекарствами.
В нынешних условиях ни одна фармацевтическая компания не может рассчитывать на возмещение огромных затрат на разработку новых антибиотиков. Большинство крупных фирм, оснащенных для клинических испытаний, уже ушли из арены именно из-за этой причины.
Производство пенициллина в США во время Второй мировой войны
Говард Флори признал, что крупномасштабное производство пенициллина невозможно осуществить в Британии, где химическая промышленность была полностью поглощена военными действиями. При поддержке фонда Рокфеллера Флори и его коллега Норман Хитли летом 1941 года отправились в Соединенные Штаты. Они планировали заинтересовать американскую фармацевтическую промышленность производством пенициллина в больших масштабах.
Йельский физиолог Джон Фултон связал своих британских коллег с людьми, которые могли бы помочь им в достижении этой цели. И вскоре она была достигнута – заняться производством решила Северная региональная исследовательская лаборатория Департамента (NRRL) в Пеории, штат Иллинойс.
Через несколько недель ученый Эндрю Мойер обнаружил, что можно значительно увеличить выход пенициллина, заменив лактозу, которые использовали оксфордские исследователи, сахарозой
Вскоре после этого он сделал еще более важное открытие – Мойер увидел, что добавление кукурузного раствора в среду для ферментации привело к десятикратному увеличению выхода
Вскоре начался глобальный поиск лучших штаммов, которые продуцируют пенициллин. Образцы почв отправлялись в NRRL со всего мира. По иронии судьбы, наиболее подходящей оказалась заплесневевшая дыня с фруктового рынка Пеории. Более продуктивный мутант так называемого штамма канталупы был получен с использованием рентгеновских лучей в Институте Карнеги. Время шло, а применение пенициллина все еще ограничивалось клиническими испытаниями.
Стадии ферментации, восстановления, очистки и упаковки быстро уступили совместным усилиям ученых-химиков и инженеров, которые работали над экспериментальным производством пенициллина. 1 марта 1944 года компания Pfizer открыла первый коммерческий завод для крупномасштабного производства пенициллина в Бруклине, Нью-Йорк.
Эффект от разных препаратов
Есть резон выяснить, влияет ли на то, когда начинает действовать антибиотик, конкретный препарат или любое лекарство этой группы демонстрирует эффект приблизительно в одинаковый временной промежуток? Для этого стоит просто изучить инструкции по применению к препаратам.
Например, информация о том, когда начинает действовать антибиотик «Супракс» третьего поколения, разнится от 4 до 12 часов. То есть больной мгновенно чувствует облегчение состояния, если препарат принят по показаниям.
Ответ на вопрос, когда начинает действовать антибиотик «Флемоксин Солютаб», зависит от того, как именно его применять. Если выпивать таблетки при заболеваниях, указанных в перечне показаний, улучшение самочувствия наступает на вторые-третьи сутки.
Но если использовать их местно, рассасывая как пастилки от боли в горле, то эффект будет практически мгновенным. Правда, курс приема придется завершить полностью, даже если боль в горле полностью исчезнет на первый день.
Когда использовать антибиотики?
Антибиотики могут быть бактериостатическими или бактерицидными. В первом случае они препятствуют размножению бактерий, во втором – они уничтожают живые клетки. При этом антибиотики эффективны только тогда, когда инфекция вызвана бактериями. Поэтому назначение антибиотика должно происходить только тогда, когда врач уверен, что инфекция бактериальная.
К сожалению, тесты, подтверждающие этиологию инфекции, проводятся редко. При назначении антибиотика врачи обычно полагаются на конкретные симптомы бактериальной инфекции и место возникновения инфекции, зная, что определенные группы бактерий вызывают определенные симптомы.
Если у врача есть сомнения относительно происхождения заболевания, он обязан назначить анализ, подразумевающий посев биологической жидкости, например, мокроты, на специальную питательную среду. На таких средах бактерии быстро разрастаются, образуя колонии, хорошо различимые под микроскопом.
Затем можно воздействовать на выявленные бактерии разными антибиотиками, чтобы понять, какой из них будет уничтожать обнаруженный вид бактерий. Такой же анализ необходимо провести, если лечение уже назначенным антибиотиком остается неэффективным.
Группы антибиотиков
Несмотря на многообразие этой группы препаратов, все их можно отнести к нескольким основным видам. В основе этой классификации лежит химическая структура – лекарства из одной группы имеют схожую химическую формулу, отличаясь друг от друга наличием или отсутствием определенных фрагментов молекул.
Классификация антибиотиков подразумевает наличие групп:
- Производные пенициллина. Сюда относятся все препараты, созданные на основе самого первого антибиотика. В этой группе выделяют следующие подгруппы или поколения пенициллиновых препаратов:
- Природный бензилпенициллин, который синтезируется грибами, и полусинтетические препараты: метициллин, нафциллин.
- Синтетические препараты: карбпенициллин и тикарциллин, обладающие более широким спектром воздействия.
- Мециллам и азлоциллин, имеющие еще более широкий спектр действия.
- Цефалоспорины – ближайшие родственники пенициллинов. Самый первый антибиотик этой группы – цефазолин С, вырабатывается грибами рода Cephalosporium. Препараты этой группы в большинстве своем обладают бактерицидным действием, то есть убивают микроорганизмы. Выделяют несколько поколений цефалоспоринов:
- I поколение: цефазолин, цефалексин, цефрадин и др.
- II поколение: цефсулодин, цефамандол, цефуроксим.
- III поколение: цефотаксим, цефтазидим, цефодизим.
- IV поколение: цефпиром.
- V поколение: цефтолозан, цефтопиброл.
Отличия между разными группами состоят в основном в их эффективности – более поздние поколения имеют больший спектр действия и более эффективны. Цефалоспорины 1 и 2 поколений в клинической практике сейчас используются крайне редко, большинство из них даже не производится.
- Макролиды – препараты со сложной химической структурой, оказывающие бактериостатическое действие на широкий спектр микробов. Представители: азитромицин, ровамицин, джозамицин, лейкомицин и ряд других. Макролиды считаются одними из самых безопасных антибактериальных препаратов – их можно применять даже беременным. Азалиды и кетолиды – разновидности макорлидов, имеющие отличия в структуре активных молекул.
Еще одно достоинство этой группы препаратов – они способны проникать в клетки человеческого организма, что делает их эффективными при лечении внутриклеточных инфекций: хламидиоза, микоплазмоза.
- Аминогликозиды. Представители: гентамицин, амикацин, канамицин. Эффективны в отношении большого числа аэробных грамотрицательных микроорганизмов. Эти препараты считаются наиболее токсичными, могут привести к достаточно серьезным осложнениям. Применяются для лечения инфекций мочеполового тракта, фурункулеза.
- Тетрациклины. В основном этой полусинтетические и синтетические препараты, к которым относятся: тетрациклин, доксициклин, миноциклин. Эффективны в отношении многих бактерий. Недостатком этих лекарственных средств является перекрестная устойчивость, то есть микроорганизмы, выработавшие устойчивость к одному препарату, будут малочувствительны и к другим из этой группы.
- Фторхинолоны. Это полностью синтетические препараты, которые не имеют своего природного аналога. Все препараты этой группы делятся на первое поколение (пефлоксацин, ципрофлоксацин, норфлоксацин) и второе (левофлоксацин, моксифлоксацин). Используются чаще всего для лечения инфекций ЛОР-органов (отит, синусит) и дыхательных путей (бронхит, пневмония).
- Линкозамиды. К этой группе относятся природный антибиотик линкомицин и его производное клиндамицин. Оказывают и бактериостатическое, и бактерицидное действия, эффект зависит от концентрации.
- Карбапенемы. Это одни из самых современных антибиотиков, действующих на большое количество микроорганизмов. Препараты этой группы относятся к антибиотикам резерва, то есть применяются в самых сложных случаях, когда другие лекарства неэффективны. Представители: имипенем, меропенем, эртапенем.
- Полимиксины. Это узкоспециализированные препараты, используемые для лечения инфекций, вызванных синегнойной палочкой. К полимиксинам относятся полимиксин М и В. Недостаток этих лекарств – токсическое воздействие на нервную систему и почки.
- Противотуберкулезные средства. Это отдельная группа препаратов, обладающих выраженным действием на туберкулезную палочку. К ним относятся рифампицин, изониазид и ПАСК. Другие антибиотики тоже используют для лечения туберкулеза, но только в том случае, если к упомянутым препаратам выработалась устойчивость.
- Противогрибковые средства. В эту группы отнесены препараты, используемые для лечения микозов – грибковых поражений: амфотирецин В, нистатин, флюконазол.
Способы их применения
В медицине есть несколько способов применения антибиотиков:
- Пероральный,
- Парентеральный,
- Ректальный.
Первый способом называют прием лекарств через рот, он же является самым популярным. Существуют разные виды препаратов на основе антибиотиков. Это могут быть не только таблетки, но и капсулы, суспензии и тому подобное. Пероральный способ хорошо подходит для амбулаторного лечения как взрослых, так и детей. Недостатками таблеток может стать не очень хорошая эффективность лечения и возможные проблемы с желудочно-кишечным трактом.
Парентеральный способ является самым эффективным. В этом случае антибиотики вводятся в организм с помощью инъекций, капельниц. Больным назначаются антибактериальные препараты, которые чаще всего вводятся в виде уколов внутривенно или внутримышечно.
Парентеральный способ применяется в наиболее тяжелых случаях.
Антибиотики можно вводить в организм и ректально. Это может производится с помощью свечей или клизм.
Существуют дополнительные способы применения, которые эффективно справляются с инфекциями на местном уровне. Это могут быть вагинальные свечи, мази и тому подобное.
Широкий и узкий спектр
Антибиотики можно условно поделить на две категории: широкого и узкого спектра действия. Широта действия антибиотика означает, как много различных бактерий может уничтожить таблетка.
Антибиотики узкого спектра врачи применяют, только когда точно знают возбудителя заболевания. Конечно, такое назначение более точное, но не всегда у врачей бывает время на определение возбудителя болезни, так как посев крови может занимать до нескольких суток, а состояние больного может ухудшаться.
В этом случае назначаются антибиотики широкого спектра, которые уничтожают все потенциально опасные микроорганизмы, правда, под удар попадают и полезные микробы, в результате чего возникает дисбактериоз.
Как антибиотики влияют на печень, почки?
Печень – это своеобразный фильтр в организме. Если печень абсолютно здорова, некоторое время она без проблем сможет выдержать повышенную нагрузку, нейтрализуя токсические вещества. Но если функции печени нарушены, антибиотикотерапия должна обязательно сопровождаться приемом гепатопротекторов (Уросан, Гепабене, Карсил).
Однако заболевания мочевыделительной системы или длительный прием антибиотиков может стать причиной изменения процессов выведения и всасывания химических элементов, развития патологических реакций.
Боль в пояснице свидетельствует о нарушении функции почек от приема антибиотиков
Продолжение великого дела
Сесил Джордж Пейн, патологоанатом в Королевском лазарете в Шеффилде, попытался лечить сикоз (извержения в фолликуле) пенициллином, но его эксперимент не увенчался успехом, вероятно, потому, что препарат не проникал достаточно глубоко. Перейдя к лечению офтальмии новорожденных, гонококковой инфекции у младенцев, он добился первого удачного исцеления 25 ноября 1930 года. Он вылечил четырех пациентов (одного взрослого и трех младенцев) от глазных инфекций, хотя пятому пациенту не повезло.
В Оксфорде Говард Уолтер Флори организовал большую и очень опытную группу по биохимическим исследованиям, среди которых были Эрнст Борис Цейн и Норман Хитли, чтобы провести клинические испытания и произвести стабильный пенициллин в необходимом количестве. В 1940 году Цейн и Эдвард Абрахам сообщили о первом признаке устойчивости антибиотиков к пенициллину, штамму E.coli, который продуцировал фермент пенициллиназы, способный разрушать пенициллин и полностью отрицать его антибактериальное действие.

Фаготерапия
Фаготерапия — еще один метод лечения устойчивых к антибиотикам штаммов бактерий. Фаготерапия заражает патогенные бактерии собственными вирусами. Бактериофаги чрезвычайно специфичны для определенных бактерий, поэтому они не вредят организму-хозяину и микрофлоре кишечника в отличие от антибиотиков. Бактериофаги, также известные как фаги, заражают и могут убивать бактерии и влиять на рост бактерий прежде всего в течение литических циклов. Фаги вставляют свою ДНК в бактерию, где ее транскрибируют и используют для создания новых фагов, после чего клетка будет лизироваться, высвобождая новый фаг, способный заражать и уничтожать другие бактерии одного и того же штамма. Высокая специфичность фага защищает «хорошие» бактерии от разрушения.
Однако существуют и некоторые недостатки в использовании бактериофагов. Бактериофаги могут содержать факторы вирулентности или токсичные гены в своих геномах. Кроме того, пероральное и внутривенное введение фагов для уничтожения бактериальных инфекций представляет собой гораздо более высокий риск безопасности, чем местное применение, и есть дополнительная проблема неопределенного иммунного ответа на эти крупные антигенные коктейли. Существуют значительные регуляторные препятствия, которые необходимо преодолеть для таких рискованных методов лечения. Использование бактериофагов в качестве замены противомикробных препаратов остается привлекательным вариантом, несмотря на многочисленные проблемы.
История открытия антибиотиков и их роль на Земле
29.03.2011
История открытия антибиотиков связана с именами английского ученого А. Флеминга и американских ученых Г. Дюбо и С. Ваксмана. А. Флеминг в 1929 г. установил, что фильтрат культуры плесневого гриба Penicillium notatum содержит какое-то вещество, угнетающее рост стафилококка. Это вещество и получило название пенициллина.
Однако в чистом виде препарат был получен лишь в 1940 г., после чего стало возможным установить его химическую природу, а затем и наладить промышленное производство этого препарата, оказавшегося истинным королем антибиотиков по силе воздействия на бактерии и относительной безвредности для человека.
Г. Дюбо выделил из культуры Bacillus brevis два антибиотика — тироцидин и грамицидин, однако они не получили столь широкого применения, как пенициллин. Последний оказался очень эффективным для лечения гнойно-воспалительных заболеваний, вызываемых стафилококками, которые по своей частоте всегда занимали ведущее место среди прочих бактериальных инфекций. Вместе с тем пенициллин оказался эффективным средством и против других видов грамположительных бактерий.
С. Ваксман открыл ряд антибиотиков, продуцентами которых были различные виды актиномицетов, и в том числе в 1944 г. — стрептомицин; его продуцентом является Actinomyces griseus.
Значение открытия стрептомицина заключается в том, что он и его производные оказались очень эффективными препаратами для лечения туберкулеза и чумы. Кроме того, стрептомицин оказался гораздо более эффективным, чем пенициллин, против грамотрицательных бактерий.
В связи с открытием пенициллина и стрептомицина стало возможным успешно лечить большую часть бактериальных инфекций. Фактически в течение двух десятилетий (с 1940 по 1960 гг.) были открыты все наиболее часто применяемые антибиотики:
стрептомицин (1944);
хлорамфеникол, полимиксин (1947);
хлортетрациклин (1948);
бензилпенициллин, неомицин (1949);
нистатин (1950);
эритромицин, циклосерин (1952);
новобиоцин (1953);
олеандомицин (1954);
канамицин (1955);
леворин (1959).
Темпы изыскания новых и совершенствования препаратов на основе старых антибиотиков не снижаются. Возникла и развивается быстрыми темпами промышленность, в том числе на основе биологической технологии, производящая антибиотики в огромном количестве.
Если в 1943 г. было произведено всего 13 кг пенициллина, то сейчас ежегодно выпускаются десятки тысяч тонн антибиотиков все новых и новых поколений. Одних только антибиотиков пенициллинового ряда (беталактамные антибиотики) выпускается около 100 наименований препаратов. Они по-прежнему занимают доминирующее положение в клинике.
Результаты применения антибиотиков в медицине оказались исключительно впечатляющими. Они во много раз сократили смертность, особенно детскую, от инфекционных болезней, смягчили тяжесть их течения, уменьшили количество постинфекционных осложнений.
В результате применения антибиотиков уже к концу 50-х гг. XX в. средняя продолжительность жизни людей на Земле, особенно в развивающихся странах, заметно выросла. Не менее важную роль сыграли и играют антибиотики и в сельском хозяйстве, особенно в животноводстве и птицеводстве, для лечения и профилактики инфекционных заболеваний среди поголовья скота и птиц. Для начинающих изучать иностранный язык есть возможность обучиться, никуда не выходя из дома. Сайты, где можно изучить английский язык онлайн, представлены на go-english.ru.
Антибиотики: для превращения из незаменимых лекарств в бесполезные потребовалось 100 лет
Первым антибиотиком был пенициллин, открытый около 100 лет назад. Этот простой препарат вывел антибиотики на передний край современной медицины, позволив врачам добиваться излечения тяжелых инфекций и делать успешные операции, которые ранее в большинстве случаев убивали пациентов. Благодаря антибиотикам, предотвращающим и останавливающим опасные инфекции, стали повседневной реальностью сложнейшие операции по замене тазобедренных суставов и пересадке органов.
Но из-за злоупотребления антибиотиками, многие бактерии, получившие название «супербаги», адаптировались к лечению. Чтобы противостоять действию определенных антибиотиков, они научились использовать и передавать гены. Этот процесс называется лекарственной устойчивостью.
Число супербагов постоянно растет. По статистике, в 34 странах Организации экономического сотрудничества и развития (ОЭСР), где около половины рецептов антибиотиков использовались ненадлежащим образом, резистентны 17% бактериальных инфекций. В Индии эта цифра достигает 60%.
Поскольку лекарственно-устойчивые инфекции угрожают здравоохранению в больших масштабах, без открытия новых антибиотиков современная медицина быстро скатится к Темным векам, где царила повсеместная инфекция. Уже сегодня жертвами устойчивости к антибиотикам стало 700000 человек. И ещё 6000000 человек умирают от невылеченных инфекций.
Быстро становятся небезопасными инфекции мочевыводящих путей и инфекции новорожденных, что связано с нехваткой рабочих антибиотиков для борьбы с бактериями Escherichia coli, устойчивой к метициллину, Staphylococcus aureus и Klebsiella pneumoniae. Еще одна огромная проблема – лекарственно-устойчивый туберкулез.
Ученые предупреждают: если не будет внедрен контроль и надзор за лечением инфекций, даже новые антибиотики, в итоге станут устойчивыми.
Процесс изготовления антибиотиков
Начало процесса
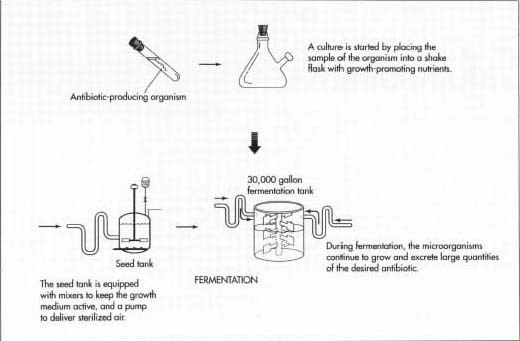
Сеялки — это стальные резервуары, предназначенные для создания идеальной среды для выращивания микроорганизмов. Они наполнены всеми вещами, необходимыми для того, чтобы выжил и начал процветать конкретный микроорганизм, включая теплую воду и углеводные продукты, такие как лактоза или сахара глюкозы.
Кроме того, они содержат другие необходимые источники углерода, такие как уксусная кислота, спирты или углеводороды, а также источники азота, такие как соли аммиака. Факторы роста, такие как витамины, аминокислоты и незначительные питательные вещества, дополняют состав содержимого семенного резервуара.
Семенные резервуары оснащены мешалками, которые поддерживают перемещение среды роста, и насос для доставки стерилизованного, отфильтрованного воздуха. Примерно через 24-28 часов материал в семенных резервуарах переносится в первичные ферментационные резервуары.
Ферментация
Бак для брожения по существу представляет собой более крупную версию стального, семенного резервуара, способного удерживать около 30 000 галлонов ферментационного бульона. Он заполнен теми же средствами роста.
Скорость действия при различных заболеваниях
Если под действием антибиотика подразумевать значительное улучшение самочувствия больного, то важно представлять, о каком именно заболевании идет речь. На вопрос, когда начинают действовать антибиотики при ангине, врачи дают ответ: в конце вторых суток приема
Если к этому времени человек не чувствует себя лучше, у него продолжает держаться высокая температура, боль в горле и признаки общей интоксикации, значит, у пациента может быть резистентность к данному типу антибиотиков. Особенно если он уже пил их раньше, бросая курс сразу после первых признаков улучшения. В этом случае рекомендуется подождать еще одни сутки, а после решать вопрос о смене препарата
На вопрос, когда начинают действовать антибиотики при ангине, врачи дают ответ: в конце вторых суток приема. Если к этому времени человек не чувствует себя лучше, у него продолжает держаться высокая температура, боль в горле и признаки общей интоксикации, значит, у пациента может быть резистентность к данному типу антибиотиков. Особенно если он уже пил их раньше, бросая курс сразу после первых признаков улучшения. В этом случае рекомендуется подождать еще одни сутки, а после решать вопрос о смене препарата.
Говоря об ангине, важно понимать, что фактором, который говорит о том, когда начинает действовать антибиотик, является в первую очередь нормализация температуры. Боль при глотании может сохраняться больше, так как для того чтобы отек сошел со слизистой, требуется больше времени
Кроме того, к болевым ощущениям в горле от болезни может добавиться травматическая боль, если пациент не соблюдал специальную диету, щадящую слизистую горла.

А на вопрос, когда начинают действовать антибиотики при бронхите, врачи дают другой ответ: пациент должен почувствовать облегчение через 12-15 часов после приема препарата. Конечно, многое зависит от степени тяжести бронхита и конкретного препарата, но ориентировочно есть возможность представить промежуток времени, после которого можно говорить о неправильном выборе препарата ввиду его неэффективности.
Как действуют антибиотики?
Стратегия у антибиотиков разных групп различна.
Одни из них подавляют синтез основного компонента клеточной стенки бактерий, которая обеспечивает ее форму (палочка, кокк) и защищает клетку от различных внешних воздействий. Без нее микробы погибают. Так действуют пенициллины и цефалоспорины.
Другие препараты повреждают цитоплазматическую мембрану, находящуюся под клеточной стенкой. Через нее происходит обмен веществ бактерии с внешней средой, доставляются необходимые вещества и удаляются конечные продукты обмена. Поврежденная мембрана не в состоянии выполнять свои функции, поэтому рост и развитие микроба останавливается.
Третьи угнетают синтез белка внутри самой клетки. Это приводит к замедлению процессов жизнедеятельности, и клетка «засыпает». Таков механизм действия у макролидов, аминогликозидов, тетрациклинов, линкозамидов.