Какое строение гемоглобина
Содержание:
- Строение гемоглобина
- Способы предотвращения окисления железа гемоглобина
- Строение[править | править код]
- Методика и техника выявления
- Методика определения уровня гемоглобина крови. Норма гемоглобина
- Необычные гемоглобинопатии
- Какие продукты повышают гемоглобин
- Диагностическое значение
- Гемоглобин при заболеваниях крови
- Методы определения гемоглобина в крови: какой подсчет практичнее?
- Клиническое значение определения гемоглобина
- Причины повышения гемоглобина, лечение
- Строение[править | править код]
- Важность фетального гемоглобина для новорожденного
Строение гемоглобина
Гемоглобин – это сложный белок. Даже само слово “гемоглобин”, если внимательно присмотреться, сложное. Оно состоит из двух частей – глобина (белковый компонент) и гема (небелковая часть молекулы).
Если рассматривать гемоглобин с точки зрения популярности – то это самая настоящая классика жанра. Откройте любой учебник в разделе “белки”. В 99 случаях из 100, в качестве примера четвертичной структуры белка будет молекула гемоглобина. А рядом картинка такого плана:
В состав гемоглобина входит четыре молекулы гема, каждая из которых буквально обвита белковой цепью. Внутри гема есть один атом железа. Эта структура является пигментом, который окрашивает кровь в привычный нам цвет. Именно за счет гемоглобина наша кровь красная.
Железо в гемоглобине двухвалентное. Не хотелось бы усложнять статью химией, но это важный момент, к которому мы еще вернемся.
Гемоглобина в эритроците довольно много. Около 400 млн молекул в одной клетке. Он занимает практически 95% сухого остатка эритроцита.
Синтез гемоглобина
Синтез гемоглобина происходит в печени, костном мозге, кишечнике и почках. Важную роль в этом процессе играет железо. Часть его организм использует повторно. То есть при распаде гемоглобина большая часть железа остается в организме и идет на построение новых молекул гемоглобина. Немного железа поступает в организм с пищей. Таким образом происходит обновление этого макроэлемента.
Люди интересуются – можно ли насытить организм железом впрок? Нет, даже если вы принимаете препараты с высоким содержанием железа, его излишки покидают организм. При нормальном обмене веществ нам никак не превратиться в железного человека.
Железо откладывается в виде специального белка – ферритина. В составе этого соединения оно трехвалентное. Для того чтобы его превратить в двухвалентную форму, которая как мы помним входит в состав гемоглобина, нужны определенные условия. А именно — наличие таких катализаторов как витамин С и витамины группы В. Без этих веществ и всасывание железа в кишечнике будет весьма затруднительно.
В конце своего жизненного срока (примерно 120 дней), гемоглобин распадается на составляющие. Гем теряет железо, приобретает зеленый оттенок, а затем превращается в желтый билирубин. Билирубин входит в состав желчи, и когда его много, он дает симптомы желтухи. Одним из признаков массового распада гемоглобина является желтушность кожи и склер глаз.
Наверняка, вы обращали внимание на то, как изменяется цвет гематомы (синяка) при ушибе. Сначала она красная, потом синяя
Это признаки воспаления. А потом появляется другая цветовая гамма – от зеленого до коричневого. Это как раз и есть наглядный пример распада гемоглобина и превращение его составляющих в билирубин.
Способы предотвращения окисления железа гемоглобина
Для поддержания здоровья стоит знать, как предотвратить образование излишнего метгемоглобина в крови. Для этой цели есть два способа.
- Предотвратить патогенное воздействие, проникших в эритроциты крови окислителей железа до того, как они повредят молекулы гемоглобина. Для этого в кровь вводится энзим глутатионпероксидаза. При этом восстановленный глутатион воздействует на патогенные окислители в крови, обезвреживает их и предотвращает синтез метгемоглобина. Данный способ поможет предотвратить дальнейшее развитие метгемоглобинемии, однако может привести к образованию в крови веществ, полученных в результате денатурации гемоглобина – телец Гейнтца.
- Восстановить повреждённые окисленным железом молекулы гемоглобина. Данный способ применяется при помощи двух ферментативных систем: НАНД-зависимой и НАНДФ-зависимой метгемоглобинредуктазы. В первой системе восстанавливающими повреждённый гемоглобин веществами выступают продукты анаэробного этапа переработки глюкозы (НАНД), во второй – гексозомонофосфатного преобразования (НАНДФ). В результате гексозомонофосфатного превращения при воздействии гексозо-6-фосфатдегидрогеназы (Г-6ф-ДГ) синтезируется восстанавливающий агент – никатинамид – адениндинуклеотд фосфат (НАНДФН). Он принимает участие в трансформации метгемоглобина в гемоглобин в присутствии НАДФН-метгемоглобинредуктазы, а также в результате восстановления окисленного трехвалентного железа при участии НАНДФ-зависимой глутатионредуктазы.
Метгемоглобин – опасное для здоровья вещество. Синтезирование гемоглобина в метгемоглобин приводит к серьезным нарушениям состава и качества крови. Во избежание концентрации его в организме необходимо систематически проводить профилактические процедуры и следить за дозировкой применяемых лекарств.
О влиянии нитратов на организм человека рассказывается в представленном видеосюжете:
Строение[править | править код]
Гемоглобин является сложным белком класса гемопротеинов, то есть в качестве простетической группы здесь выступает гем — порфириновое ядро, содержащее железо. Гемоглобин человека является тетрамером, то есть состоит из 4 протомеров. У взрослого человека они представлены полипептидными цепями α1, α2, β1 и β2. Субъединицы соединены друг с другом по принципу изологического тетраэдра. Основной вклад во взаимодействие субъединиц вносят гидрофобные взаимодействия. И α-, и β-цепи относятся к α-спиральному структурному классу, так как содержат исключительно α-спирали. Каждая цепь содержит восемь спиральных участков, обозначаемых буквами от A до H (от N-конца к C-концу).
Гем представляет собой комплекс протопорфирина IX, относящегося к классу порфириновых соединений, с атомом железа(II). Этот кофактор нековалентно связан с гидрофобной впадиной молекул гемоглобина и миоглобина.
Железо(II) характеризуется октаэдрической координацией, то есть связывается с шестью лигандами. Четыре из них представлены атомами азота порфиринового кольца, лежащими в одной плоскости. Две другие координационные позиции лежат на оси, перпендикулярной плоскости порфирина. Одна из них занята азотом остатка гистидина в 93-м положении полипептидной цепи (участок F). Связываемая гемоглобином молекула кислорода координируется к железу с обратной стороны и оказывается заключённой между атомом железа и азотом ещё одного остатка гистидина, располагающегося в 64-м положении цепи (участок E).
Всего в гемоглобине человека четыре участка связывания кислорода (по одному гему на каждую субъединицу), то есть одновременно может связываться четыре молекулы. Гемоглобин в лёгких при высоком парциальном давлении кислорода соединяется с ним, образуя оксигемоглобин. При этом кислород соединяется с гемом, присоединяясь к железу гема на 6-ю координационную связь. На эту же связь присоединяется и монооксид углерода, вступая с кислородом в «конкурентную борьбу» за связь с гемоглобином, образуя карбоксигемоглобин.
Связь гемоглобина с монооксидом углерода более прочная, чем с кислородом. Поэтому часть гемоглобина, образующая комплекс с монооксидом углерода, не участвует в транспорте кислорода. В норме у человека образуется 1,2 % карбоксигемоглобина. Повышение его уровня характерно для гемолитических процессов, в связи с этим уровень карбоксигемоглобина является показателем гемолиза.
Методика и техника выявления
Выраженная Г. может быть определена визуально по интенсивности красной окраски плазмы исследуемой крови. Количественное определение свободного гемоглобина плазмы проводят на фотоколориметре по Бингу в модификации Г. В. Дервиза и Н. К. Бялко (1966). Методика позволяет выявить даже незначительный гемолиз.
Метод основан на выявлении пероксидазных свойств гемоглобина с помощью бензидиновой реакции. Реактивы: ацетатный буфер, перекись водорода и солянокислый бензидин. Кровь для анализа берут из вены сухой иглой и обязательно в силиконированную пробирку с антикоагулянтом. Центрифугируют не более 10 мин. при 1500 об/мин (чтобы не повредить эритроциты). Плазму (после отделения) вновь центрифугируют 10 мин. при 8000 об/мин. В пробирку наливают ацетатный буфер, перекись водорода, раствор бензидина и испытуемую плазму. Смешивают и оставляют стоять на 3 мин. Одновременно готовят контрольный раствор. Фотометрируют при красном светофильтре. Интенсивность голубой окраски нарастает в течение 4—5 мин., поэтому .величину оптической плотности измеряют 3—5 раз и регистрируют максимальные показания. Через 5—6 мин. окраска приобретает лилово-буроватый оттенок и оптическая плотность начинает уменьшаться. Результат берут средний из определения оптической плотности двух параллельных проб.
Количество растворенного гемоглобина в миллиграмм-процентах определяют на калибровочной кривой по оптической плотности.
Методика определения уровня гемоглобина крови. Норма гемоглобина
Дозировка гемоглобина имеет первостепенное значение для оценки эритроцитного раздела, поскольку представляет собой функциональный элемент. Учитывая тот факт, что гемоглобин в чистом состоянии получается весьма трудно, и как таковой не подлежит дозировке, в текущей практике применяются косвенные методы дозировки.
Среди многочисленных существующих способов наиболее простым и точным методом гемоглобинометрии считается фотометрическое определение в виде цианметгемоглобина, а для эталонирования фотометров — использование стандартных растворов цианметгемоглобина, приготовленных из человеческого гемоглобина.
Принципы определения гемоглобина в крови. Железосинеродистый калий окисляет железистое железо гемоглобина, в результате чего все виды гемоглобина крови преобразуются в метгемоглобин. Последний комбинируется с цианистым калием, образуя цианметгемоглобин или циангемоглобин — наиболее устойчивое производное гемоглобина.
Состав используемого реагента следующий (по van Kampen-Zijlstra):– Железосинеродистый калий 0,2 г– Цианистый калий (KGN) 0,05 г– Монокалиевый фосфат (КН2РО4) 0,14 г– Дистилированная вода до 1000 мл
Показатель водорода реагента должен укладываться в пределы от 7,2 до 7,5, быть прозрачным и очень стойким. После приготовления раствор пропускается через качественный бумажный фильтр и хранится в герметически закрытых баллонах коричневого цвета, в холодильнике при температуре +4°. Хранить не более 1—2 месяцев. Периодически проверять чистоту раствора, в случае необходимости повторно фильтровать.
Раствор нетоксичен, поскольку концентрация цианистого калия значительно меньше ядовитой дозы.
Техника определения гемоглобина в крови. Влить 0,02 мл крови (содержащийся в одной пипетке гемоглобин) в пробирку с 5 мл реагента, перемешать и отставить на 20 мин. Прочет результата делать с помощью фотометра с фильтром S53 в ванночке, величиной 1 см, по сравнению с дистилированной водой.
Концентрация гемоглобина (в г/100 мл крови) определяется по формуле: Гемоглобин в г/100 мл = экстикция пробы х К(стандартная концентрация гемоглобина/стандартная экстинкция).
Калибровка фотометров осуществляется с помощью стандартного раствора гемоглобина, который у нас в стране поставляется бухарестским гематологическим Центром. Способ простой, точный, погрешность минимальная (±2%), воспроизводимость удовлетворительная.Нормальные значения колеблятся в зависимости от возраста, пола высоты над уровнем моря.
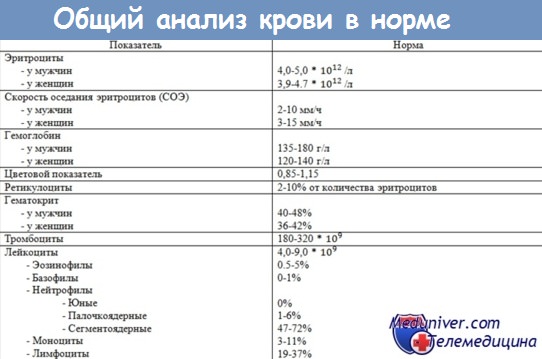
У взрослого: мужчин = 15 ± 2 г/100 мл, а женщин = = 13 ± 2 г/100 мл.
У детей от двухлетнего возраста до половозрелости значения растут прогрессивно от 11 до 13 г/100 мл.
– Также рекомендуем “Методика определения уровня гематокрита крови. Норма гематокрита”
Оглавление темы “Гематология”:
Необычные гемоглобинопатии
Существует ряд гемоглобинопатий, некоторые из которых не проявляются – они не вызывают никаких клинических признаков или симптомов. Другие, в свою очередь, влияют на функциональность и / или стабильность молекулы гемоглобина. Примерами являются гемоглобин D, гемоглобин G, гемоглобин J, гемоглобин M и гемоглобин Constant Spring. Мутации в гене альфа-цепи глобина приводят к образованию аномально длинных альфа (а) цепей, которые вызывают нестабильность в молекуле гемоглобина.
Другие примеры мутаций бета-цепи:
- Гемоглобин F: Hb F в основном вырабатывается в организме будущего ребенка (плода), и его функция заключается в переносе кислорода в среде с низким содержанием кислорода. Продукция гемоглобина F снижается сразу после рождения и стабилизируется на уровне взрослого человека до 1-2 лет. Гемоглобин F может быть повышен при некоторых врожденных заболеваниях. При бета-талассемии его уровень может быть нормальным или повышенным, но часто повышен при серповидно-клеточной анемии и сочетании серповидно-клеточной анемии с бета-талассемией. Пациенты с серповидно-клеточной анемией и повышенным Hb F часто имеют более легкое течение болезни, поскольку Hb F предотвращает серповидное движение красных кровяных телец. Уровни Hb F повышены в редком состоянии, называемом врожденным постоянством выработки гемоглобина плода (HPFH). Люди с повышенным уровнем гемоглобина F не имеют клинических признаков. HPFH вызывается разными генными мутациями у разных этнических групп. Hb F также может быть повышен при некоторых приобретенных состояниях, влияющих на выработку красных кровяных телец. Например, лейкемия и миелопролиферативные заболевания часто сопровождаются небольшим повышением уровня гемоглобина F.
- Гемоглобин H: HbH – это аномальный гемоглобин, который возникает в некоторых случаях альфа-талассемии. Его образование является ответом на фундаментальный недостаток альфа (а) цепей. Hb H состоит из четырех цепей бета (b) глобина. Хотя каждая из цепей бета-глобина нормальна, комплекс из четырех цепей бета нормально не функционирует. Обладает повышенным сродством к кислороду, плохо выделяет кислород клеткам тканей. Присутствие гемоглобина H также связано со значительным распадом эритроцитов (гемолизом), который возникает в результате осаждения нестабильного гемоглобина внутри красных кровяных телец.
- Hemoglobin Barts: Hb Barts вырабатывается в организме будущего ребенка с альфа-талассемией при условии, что все четыре гена, отвечающие за производство гемоглобина альфа, отсутствуют. Таким образом, не может образовываться гемоглобин HbA, HbA 2 и HbF. Гемоглобин Бартс состоит из четырех гамма (g) цепей и имеет высокое сродство к кислороду. Это состояние несовместимо с жизнью и обычно приводит к внутриутробной гибели плода.
Некоторые люди могут унаследовать два гена с разными мутациями, каждый от одного из родителей. Таких людей называют двойными или смешанными гетерозиготами.
Какие продукты повышают гемоглобин
Для производства гемоглобина нужны аминокислоты и железо. Казалось бы, если употреблять продукты с высоким содержанием железа, это должно решить проблему. Но на самом деле не все так просто. Рассмотрим, какие продукты можно и нужно употреблять для повышения гемоглобина.
Печень
Повысить гемоглобин поможет любой вид печени: куриная, свиная или говяжья. Вид роли не играет, тут главное степень прожарки — она должна быть слабой, именно при ней большая часть полезных микроэлементов сохраняется.
Мясо
Основу любого вида мяса составляют белки и незаменимые аминокислоты, а они в свою очередь вступают в химическую реакцию с железом, после чего образовываются молекулы гемоглобина. Лучше всего употребять кроличье, свиное или говяжье мясо. Идеальный вариант готовки — приготовление на пару. Главное, чтобы было как можно меньше термической обработки.
Гречка
Практически все виды зерновых культур способствуют снижению биодоступности железа. Исключением является только гречневая крупа, у которой обратное действие, к тому же, в ней содержится железо. Ее рекомендуют для прикорма грудных детей вместо манной крупы, в которой содержится кальций (снижает уровень гемоглобина).
Халва
Всего 50 грамм такого десерта обеспечат суточную норму железа в организме. Но стоит учесть, что витаминов В-группы и аскорбиновой кислоты в халве практически нет. Поэтому если вы решили включить ее в свой рацион, нужно позаботиться о питательных микроэлементах, которые поспособствуют усваиванию железа.
Свекла
Особенность столовой свеклы – все питательные микроэлементы в ней сохраняются даже при термической обработке. Можно также включить в рацион свекольный сок, но пить его следует в разбавленном виде (1 часть сока на 2 части воды).
Гранат
Гранат — самый полезный фрукт из-за высокого содержания витамина В6. Железо в нем, конечно, тоже есть, но оно сконцентрировано в косточках и в малом количестве.
Морковь
Лучше всего поднимает гемоглобин красная морковь, так как именно в ней содержится бета-каротин и витамин А в большом количестве. Данные микроэлементы ускоряют биохимический реакции с использованием кальция – снижение его «свободного» уровня в крови увеличивает биодоступность железа.
Сухофрукты
Среди всех сухофруктов стоит отдать предпочтение черносливу, изюму, вишне, черешне, бананам, так как именно в этих продуктах наибольшее количество витаминов группы В, Е, С. Ускорить усвоение железа помогает также то, что в сухофруктах содержится большое количество растительной клетчатки – это комплексно нормализует работу желудочно-кишечного тракта.
Рыба
Лучше всего подойдет морская рыба жирных сортов: лосось, сёмга. Из морепродуктов хорошо зарекомендовали себя креветки и моллюски. При приготовлении нужно также свести к минимуму тепловую обработку, рыбу лучше засолить. И есть еще один очень действенный продукт, который поднимает гемоглобин в короткие сроки, – чёрная икра, хотя и красная тоже подойдет.
Ягоды
Обязательно стоит употреблять клюкву и черную смородину, продукты полезны не только в свежем, но и в замороженном виде. Клюкву можно смешивать с сахаром. При дефиците железа показаны также земляника, клубника и черника.
Ягода, полезная при малокровии и анемии, — рябина. Для достижения эффекта необходимо ежедневно съедать не менее столовой ложки.
Watch this video on YouTube
Диагностическое значение
Выраженная Г. (125—200 мг% и выше) патогномонична для гемолитических анемий, протекающих с внутрисосудистым гемолизом: при острых отравлениях гемолитическими ядами, энзимопенических гемолитических анемиях, пароксизмальной ночной гемоглобинурии, гемолитической болезни новорожденных, а также при гемолитических кризах в результате тяжелых посттрансфузионных реакций, при групповой или резус-несовместимости. При гемолитических анемиях, обусловленных преимущественно внутриклеточным гемолизом, выраженную Г. не обнаруживают. Легкая Г. (до 25 мг%) отмечается при некоторых гемоглобинопатиях (серповидноклеточная анемия и ее варианты, талассемия, гемоглобиноз С), при аутоиммунной гемолитической и пернициозной анемии, резорбции гематом. Легчайшая Г. (5—15 мг%) может иметь место при отравлении концентрированной уксусной к-той и при инфаркте миокарда.
Библиография
Алексеев Г. А. и Берлинер Г. Б. Гемоглобинурии, М., 1972; Кассирский И. А. и Алексеев Г. А. Клиническая гематология, М., 1970; М о 1 1 i s о n P. L. Blood transfusion in clinical medicine, Philadelphia, 1972; Wintrobe М. M. Clinical hematology, Philadelphia, 1974.
источник
Гемоглобин при заболеваниях крови
Дефицит гемоглобина может быть вызван, во-первых, уменьшением количества молекул самого гемоглобина (см. анемия), во-вторых, из-за уменьшенной способности каждой молекулы связать кислород при том же самом парциальном давлении кислорода.
Гипоксемия — это уменьшение парциального давления кислорода в крови, её следует отличать от дефицита гемоглобина. Хотя и гипоксемия, и дефицит гемоглобина являются причинами гипоксии.
Если дефицит кислорода в организме в общем называют гипоксией, то местные нарушения кислородоснабжения называют ишемией.
Прочие причины низкого гемоглобина разнообразны: кровопотеря, пищевой дефицит, болезни костного мозга, химиотерапия, отказ почек, атипичный гемоглобин.
Повышенное содержание гемоглобина в крови связано с увеличением количества или размеров эритроцитов, что наблюдается также при истинной полицитемии. Это повышение может быть вызвано: врождённой болезнью сердца, лёгочным фиброзом, слишком большим количеством эритропоэтина.
Методы определения гемоглобина в крови: какой подсчет практичнее?
Гемоглобин (Hb) – молекула, с помощью которой переносится кислород. Она расположена внутри зрелых эритроцитов, лишенных ядер. Клетки получают кислород из альвеол легких, переносят его органам к клеткам-мишеням. От них получают углекислый газ, и переносят его обратно в легочную систему. Без этого действия невозможна жизнь человека. Существуют различные состояния, при которых гемоглобин может повышаться или снижаться. Для диагностики используют различные лабораторные методы определения функции соединения гемоглобина. Их подбирает врач индивидуально для каждого пациента.
Клиническое значение определения гемоглобина
У взрослого человека норма концентрации Hb зависит от пола:
- женщины 11-14г/% или 110-140 г/л;
- мужчины 12-16 г/% или 120-160 г/л.
Для мужчин норма более завышена, так как они имеют большую мышечную массу, по сравнению с женщинами.
Снижение концентрации гемоглобина наблюдается при следующих состояниях и заболеваниях:
- сниженная концентрация эритроцитов в следствии железодефицитной, серповидно-клеточной анемии;
- недостаточное количество веществ, которые влияют на продукцию эритроцитов (фолиевая кислота, витамин B12);
- заболевание красного костного мозга.
Повышенная концентрация Hb наблюдается при следующих состояниях и заболеваниях:
- повышенная продукция эритроцитов при заболевании красного костного мозга, злокачественных новообразованиях;
- компенсаторное повышение количества эритроцитов вследствие сердечно-сосудистых и легочных заболеваний;
- снижение количества плазмы крови вследствие чего число форменных элементов повышается в 1 л биологической жидкости.
Гемоглобин появляется в эритроцитах после утраты ядра и приобретении зрелости клетки. Местом утилизации красных кровяных клеток и Hb является селезенка. Жизненный цикл 1 клетки совместно составляет 120 дней. После гибели в кровь выделяется железо, которое поставляется в красный костный мозг. С помощью этого элемента продуцируются новые красные кровяные тельца.
Причины повышения гемоглобина, лечение
Пониженный гемоглобин встречается часто, но что делать, если он в крови значительно повышен? Стоит ли опасаться этого явления или, наоборот, этот фактор должен обрадовать? Что значит гемоглобин высокий? Если верхний порог нормы у женщин — 140, а у мужчин — 160 г/литр крови, то, значит, все, что выше 150 и 170, и есть повышение.
Высокий уровень гемоглобина свидетельствует о дисфункции некоторых органов и систем в организме:
- Разрушение эритроцитов и попадание в плазму крови (гемоглобинемия).
- Увеличение эритроцитов в сыворотке крови (эритроцитоз).
- Затруднения проходимости кишечника.
- Легочная недостаточность.
- Избыток витаминов В9, В12.
- Раковые опухоли.
- Высокое содержание глюкозы.
- Резкое возрастание физических нагрузок.
У летчиков после полетов, у альпинистов при восхождениях тоже повышается гемоглобин. Это может произойти и от долгого нахождения на свежем воздухе. А у жителей высокогорий состояние, когда повышен гемоглобин, — норма. Так компенсируется недостаток в воздухе кислорода.
Избыточное содержание гемоглобина отрицательно влияет на мочеполовую систему, зрение ухудшается, постоянно клонит в сон, бледнеют кожные покровы, человек быстро утомляется, плохо ест. Опасность представляет и то, что кровь становится густой и вязкой, она плохо циркулирует по венам, и органы испытывают недостаток питания. К этому добавляется еще и то, что в таком состоянии образуются бляшки и тромбы, а это уже прямая дорога к инфарктам и инсультам.
Для понижения гемоглобина необходимо правильно отнестись к своему рациону. Первое, что нужно сделать, – это убрать из него продукты, в которых высокое содержание железа. Прежде всего это печень и мясо, затем фрукты и ягоды красного цвета. Не стоит принимать витамины группы В, а также и С, обязательно исключить жирную пищу, способствующую образованию холестерина, иначе усиливается угроза закупорки сосудов, — это жирное молоко и масло, сладости и копченые продукты.

Предпочтительно употреблять в пищу морепродукты, нежирную рыбу, белое куриное мясо, бобовые, салаты, больше пить жидкости, она поможет разбавить густую кровь, а врач назначит медикаментозные препараты, ее разжижающие.
Также двигательная активность и прогулки на свежем воздухе, занятия в бассейне помогут восстановить функции костного мозга, который и отвечает за выработку гемоглобина.
Строение[править | править код]
Гемоглобин является сложным белком класса гемопротеинов, то есть в качестве простетической группы здесь выступает гем — порфириновое ядро, содержащее железо. Гемоглобин человека является тетрамером, то есть состоит из 4 протомеров. У взрослого человека они представлены полипептидными цепями α1, α2, β1 и β2. Субъединицы соединены друг с другом по принципу изологического тетраэдра. Основной вклад во взаимодействие субъединиц вносят гидрофобные взаимодействия. И α-, и β-цепи относятся к α-спиральному структурному классу, так как содержат исключительно α-спирали. Каждая цепь содержит восемь спиральных участков, обозначаемых буквами от A до H (от N-конца к C-концу).
Гем представляет собой комплекс протопорфирина IX, относящегося к классу порфириновых соединений, с атомом железа(II). Этот кофактор нековалентно связан с гидрофобной впадиной молекул гемоглобина и миоглобина.
Железо(II) характеризуется октаэдрической координацией, то есть связывается с шестью лигандами. Четыре из них представлены атомами азота порфиринового кольца, лежащими в одной плоскости. Две другие координационные позиции лежат на оси, перпендикулярной плоскости порфирина. Одна из них занята азотом остатка гистидина в 93-м положении полипептидной цепи (участок F). Связываемая гемоглобином молекула кислорода координируется к железу с обратной стороны и оказывается заключённой между атомом железа и азотом ещё одного остатка гистидина, располагающегося в 64-м положении цепи (участок E).
Всего в гемоглобине человека четыре участка связывания кислорода (по одному гему на каждую субъединицу), то есть одновременно может связываться четыре молекулы. Гемоглобин в лёгких при высоком парциальном давлении кислорода соединяется с ним, образуя оксигемоглобин. При этом кислород соединяется с гемом, присоединяясь к железу гема на 6-ю координационную связь. На эту же связь присоединяется и монооксид углерода, вступая с кислородом в «конкурентную борьбу» за связь с гемоглобином, образуя карбоксигемоглобин.
Связь гемоглобина с монооксидом углерода более прочная, чем с кислородом. Поэтому часть гемоглобина, образующая комплекс с монооксидом углерода, не участвует в транспорте кислорода. В норме у человека образуется 1,2 % карбоксигемоглобина. Повышение его уровня характерно для гемолитических процессов, в связи с этим уровень карбоксигемоглобина является показателем гемолиза.
Важность фетального гемоглобина для новорожденного
Для данного белкового соединения характерно высокое химическое сродство с кислородом, поэтому оно эффективно работает при «извлечении» кислорода из гемоглобина беременной женщины и передаче к ребенку через плаценту. После рождения малыша это сродство уже не требуется, поскольку hbf гемоглобин хуже делится кислородом с тканями. В итоге это может стать решающим фактором при сердечной или легочной гипоксемии. Во избежание подобных патологий, фетальный гемоглобин начинает заменяться более функциональным гемоглобином-А еще до появления ребенка на свет.
Резкий скачок парциального давления кислорода в артериальной крови (раО2) с 25-32 мм ртутного столба у плода до 87-98 мм у новорожденного провоцирует недостаточный синтез эритроцитов в первые 6-9 недель жизни малыша. Данное негативное влияние на костномозговое кроветворение нередко вызывает физиологическую анемию. В зону риска попадают недоношенные дети, поскольку у них после рождения быстро увеличивается масса тела и литраж крови.
В конечном счете уменьшение количества гемоглобина снижает парциальное давление кислорода на ткани, что провоцирует увеличение уровня эритрпоэтина и продуцирование эритроцитов.