Антинуклеарные антитела (ana)
Содержание:
- Общие сведения
- Подготовка к анализу и методика проведения исследования
- Антинуклеарные антитела — это
- Принципы лечения отека Квинке, вызванного дефицитом C1-INH
- Почему антиспермальные антитела образуются у женщин
- Антиядерные антитела – показания к анализам
- Лечение иммунологического бесплодия
- АНА ИЛИ АНТИЦИТОПЛАЗМАТИЧЕСКИЕ АНТИТЕЛА
- Виды обследования
- Ревматоидный фактор
- Показания к исследованию
- Анализ на С-реактивный белок
- Подготовка
- Описание
- Виды обследования
Общие сведения
Антинуклеарные (антиядерные) антитела представляют собой группу аутоантител, которые, вступая в реакцию с ядрами собственных клеток организма, разрушают их. Поэтому анализ на АНА считается достаточно чувствительным маркером в диагностике именно аутоиммунных нарушений, большая часть из которых сопровождается поражением соединительной ткани. Однако некоторые из видов антинуклеарных антител обнаруживаются и при заболеваниях не иммунной этиологии: воспалительных, инфекционных, злокачественных и пр.
Наиболее специфичны антинуклеарные антитела к следующим заболеваниям:
- системная красная волчанка (СКВ) – заболевание кожи и соединительной ткани;
- дерматомиозит – поражение кожи, мышц, скелетной ткани и т.д.;
- узелковый периартериит – воспаление артериальной сосудистой стенки;
- склеродермия – уплотнение и затвердение соединительной ткани;
- ревматоидный артрит – поражение соединительной ткани суставов;
- болезнь Шегрена – поражение ткани с железистыми проявлениями (снижение секрета слезных и слюнных желез).
Антинуклеарные антитела могут обнаруживаться более чем у 1/3 больных хроническим рецидивирующим гепатитом. Также уровень АНА может возрастать в случае:
- инфекционного мононуклеоза (вирусное заболевание, сопровождается массовым поражением внутренних органов);
- лейкоза (злокачественное заболевание крови) в острой и хронической форме;
- гемолитической анемии (малокровие в результате разрушения эритроцитов);
- болезни Вальденстрема (поражение костного мозга);
- цирроза печени (хроническое заболевание, связанное с изменением структуры печеночной ткани);
- малярии;
- лепры (инфекционное поражение кожи);
- хронической почечной недостаточности;
- тромбоцитопении (снижение выработки тромбоцитов);
- лимфопролиферативных патологий (опухоли лимфатической системы);
- миастении (патологическая утомляемость мышц);
- тимомы (опухоль из вилочковой железы).
Одновременно с определением антинуклеарных антител в процессе иммуноферментного анализа оценивается концентрация иммуноглобулинов: IgA, IgM, IgG. Обнаружение этих компонентов в крови может свидетельствовать о высокой вероятности развития ревматических заболеваний и коллагенозов.
В случае, когда связь между концентрацией антител и симптоматикой у больного не обнаруживается, само присутствие антиядерных антител в крови является диагностическим критерием и может повлиять на выбор лечения. Сохранение высокого уровня антинуклеарных антител при продолжительном курсе терапии свидетельствует о неблагоприятном прогнозе заболевания. Снижение значений АНА на фоне проводимого лечения может указывать на ремиссию (чаще) или приближающийся летальный исход (реже).
Также антинуклеарные антитела могут быть обнаружены у здоровых людей до 65 лет (3-5% случаев), после 65 (до 37%).
Подготовка к анализу и методика проведения исследования

Определение антител может быть выполнено в нескольких вариантах
Анализ сдается утром натощак либо в другое время, однако не ранее 5-6 часов после последнего приема пищи. Также желательно не принимать никакие лекарственные средства до взятия крови на исследование.
Существует несколько вариантов проведения анализа, отличающихся по своей точности и возможности количественной оценки концентрации антител.
Скрининговое ИФА-исследование (иммуноферментный анализ) позволяет выявить наличие суммарных антинуклеарных антител и их титра. К плюсам метода относится его относительная дешевизна и возможность выяснить, необходимы ли расширенные исследования. При отрицательном результате анализа дальнейшие исследования чаще не показаны.
Непрямая флуоресцентная микроскопия — это метод, основанный на окрашивании антител специальными веществами, дающими под ультрафиолетовым светом зеленое свечение. Тип и характер свечения позволяет врачу лабораторной диагностики определить, с какими компонентами клетки связались антитела, а также примерно узнать их количество.
Иммуноблот-исследование позволяет определить наличие каждого типа антинуклеарных антител по отдельности. Чаще всего этот анализ назначается после положительного результата другого исследования для уточнения диагноза.
Антинуклеарные антитела — это
большой комплекс антител (более 200), преимущественно иммуноглобулины G (реже IgМ и IgА), которые появляются в результате нарушении механизма аутотолернатности при аутоиммунных и ревматических заболеваних.
ANA может быть положительным еще до появления первых симптомов. Около 95 % пациентов с системной красной волчанкой имеют антиядерные антитела. Наличие симптомов волчанки подтверждает диагноз.
Механизм образования антиядерных антител
- влияние ультрафиолетовых лучей на кожу в результате происходит активация процессов запрограммированной гибели клетки (апоптоза), что является нормальной реакцией организма, но при системных заболеваниях происходит еще и усиленная миграция лимфоцитов
- компоненты клетки, которые были ранее недоступны и невидимы для иммунной системы, такие как ядрышки, гистоны, оболочка ядра и др. «оголяются», а макрофаги, вместо того, чтоб данный материал просто «утилизировать», передают сигнал о нем по цепочке иммунного ответа
- В-лимфоциты, в ответ на сигнал макрофага, начинают вырабатывать антиядерные антитела, которые связываясь с соответствующим ангигеном образуют иммунные комплексы (ядерный антиген + антитело IgG, IgM, IgA)
- иммунные комплексы откладываются на базальной мембране различных органов и тканей, особенно сосудов, активация системы комплемента — местного воспалительного ответа
- повреждение с нарушением функции органа
Антинуклеарные антитела направлены против различных структур нормальной клетки.
- anti-Ro (SS-A) — антитела к белкам связанным с РНК Y1-Y5 в сплайсосомах
- anti-Jo1 — антитела к цитоплазматическому антигену Jo-1
- anti-dsDNA — антитела к двухцепочечной ДНК
- anti-Sm
- anti-La (SS-B) — антитела к белку, связанному с РНК-полимеразой-3
- anti-Sci 70 — антитела к ядерной топоизомеразе
- anti-U1 RNP — антитела к U1 рибонуклеопротеину
- антицентромерные антитела
- антигистоновые антитела
Принципы лечения отека Квинке, вызванного дефицитом C1-INH
Чтобы избежать приступов отека Квинке, рекомендуется избегать провокационного фактора, который может включать стресс, травму или оральные контрацептивы. Однако часто основная причина отека Квинке неизвестна, и он возникает спонтанно.
Ангионевротический отек из-за дефицита C1-INH не связан с крапивницей или другими аллергическими заболеваниями, при которых гистамин является одним из основных факторов патогенеза. Следовательно, лечение ангионевротического отека, вызванного брадикинином, антигистаминными препаратами, глюкокортикоидами и / или адреналином неэффективно.
Для лечения ангионевротического отека из-за дефицита C1-INH может быть назначено симптоматическое или профилактическое лечение. Симптоматическое лечение – это прием лекарства во время приступа ангионевротического отека.

Симптоматическое лечение ангионевротического отека
Основные препараты, применяемые при приступах приобретенного и врожденного острого ангионевротического отека, – концентрат C1-IHN, антагонист рецептора B2 икатибант и ингибитор каликреина экалантид. Если эти препараты недоступны, возможно лечение плазмой, обработанной растворителем-детергентом (SDP) или свежезамороженной плазмой.
Профилактическое лечение – это прием медикаментов для предотвращения приступа отека Квинке. Оно может быть краткосрочным или долгосрочным.
- Цель длительного профилактического лечения – снизить частоту и тяжесть спонтанных приступов ангионевротического отека. Длительное профилактическое лечение считается эффективным, когда частота возникновения ангионевротического отека снижается более чем на 50%.
- Цель краткосрочного профилактического лечения – предотвратить ангионевротический отек во время запланированной процедуры или вмешательства, например, вмешательства стоматологического происхождения.
Почему антиспермальные антитела образуются у женщин
Такие белковые соединения могут образовываться и у женщины. При этом никаких неприятных проявлений не наблюдается. Единственная жалоба, которую предъявляют пациентки, – бесплодие.
Это нарушение возникает из-за изменения свойств слизистой репродуктивного аппарата. В норме она должна защищать семенную жидкость от женского иммунитета. Однако при наличии воспалительных процессов или индивидуальных особенностей иммунитета свойства слизистой меняются. В организме образуются антитела, которые обездвиживают и даже уничтожают мужские клетки.
Иногда спермии остаются живыми, но не могут проникнуть внутрь матки, поскольку слизь цервикального канала содержит АСАТ. Живчики «дрожат» на входе, но дальше пройти не могут.
Антиспермальные антитела также нарушают оплодотворение. Из-за их присутствия спермии не могут проникнуть внутрь яйцеклетки, поэтому забеременеть при таком нарушении крайне сложно.
Выработку АСАТ провоцируют:
- Патологии иммунной системы.
- Инфекционные и воспалительные заболевания репродуктивной сферы, в том числе вызванные ЗППП.
- Применение химических лекарственных препаратов, меняющих свойства слизистой оболочки половых путей.
- Изменение свойств семенной жидкости партнера, особенно увеличение количества лейкоцитов, вызванное воспалительными процессами мочеполовой системы мужчины.
- Воспаление цервикального канала шейки матки – цервицит.
- Гормональные нарушения.
- При проведении ЭКО такая реакция может возникнуть из-за многочисленных попыток забеременеть, между которыми организм не успевает отдохнуть.
Выработка антител – индивидуальный процесс. Поэтому у женщины, которая до этого без проблем беременела от одного партнера, с другим может ничего не получиться. К сожалению, спрогнозировать такую ситуацию невозможно. Защитная система организма – тонкая сфера, поэтому ее реакции сложно предсказать.
Иногда антиспермальные антитела возникают у женщины и у мужчины. В этом случае удается забеременеть только после длительного лечения у репродуктолога, во время которого обоим партнерам будут назначены препараты, снижающие активность иммунитета в отношении сперматозоидов.
Антиядерные антитела – показания к анализам
Анализы на антиядерные антитела назначаются при сомнительных диагнозах редких заболеваний. К ним, например, относятся: системные заболевания соединительных тканей, аутоиммунный панкреатит, билиарный цирроз, некоторые раковые опухоли.
- Скрининг ANA особенно рекомендуется при симптомах аутоиммунных заболеваний, включая красную волчанку:
- длительная лихорадка с неизвестными причинами;
- суставной синдром;
- высыпания на коже;
- постоянная слабость и др.
- При артралгии/артрите, пневмоните, перикардите, эпилепсии и поражениях почек.
- При подтвержденном диагнозе СКВ (2 раза в год).
- При приеме лекарств: прокаинамида, дизопирамида, пропафенона, гидралазина и т.п..
При положительном ответе, пациента необходимо обследовать и далее, проводя более специфичные тесты. Например:
При симптомах системной склеродермии важно выявить анти-Scl-70.
Для подтверждения билиарного цирроза делают антитела к митохондриям. При этом отрицательный ответ ANA не исключает аутоиммунного заболевания.
При симптомах СКВ требуется сделать тест на антитела к двухцепочечной ДНК (анти-dsDNA)
Наличие анти-dsDNA в сочетании с клиническими признаками болезни подтверждает диагноз, даже при отрицательном ANA.
Конкретных показаний для этих сложных анализов довольно много:
-
Подозреваемые заболевания соединительной ткани:
- системная красная волчанка (наличие антител у 95-100% пациентов; специфический маркер заболевания — антитела против дцДНК);
- лекарственная волчанка (95-100% пациентов);
- антифосфолипидный синдром (40-50% пациентов);
- системный склероз (80-95% пациентов, особенно антитела против Scl70);
- полимиозит и дерматомиозит (40-80% пациентов, особенно антитела против Jo1 и против Mi2);
- синдром Шегрена (48-96% пациентов, особенно анти-Ro и анти-La антитела);
- ревматоидный артрит (около 10% пациентов);
- ювенильный идиопатический артрит (менее 10% пациентов);
- синдром Рейно (20-60% пациентов);
- фибромиалгия (15-25% пациентов);
- смешанные заболевания соединительной ткани (95-100% пациентов);
- Оценка активности заболевания и мониторинг эффективности лечения, например, антитела против дцДНК при системной красной волчанке;
- Корреляция наличия антител с появлением специфических симптомов заболевания, например синдрома Шегрена, и наличия антител против Ro и против La;
- Прогнозирование рисков заболеваемости.
Синдром Шегрена
Лечение иммунологического бесплодия
- Для снижения выработки АСАТ женщине вводят аллогенные лимфоциты партнёра, подавляющие излишнюю активность иммунной системы. Этот метод «приучает» иммунитет к чужеродным белковым соединениям. Применяются препараты, разжижающие слизистую шейки матки и облегчающие проникновение сперматозоидов внутрь.
- Мужчине назначают противовоспалительные средства и препараты, снижающие повышенную активность иммунной системы.
- Проводится лечение инфекций, в том числе ЗППП.
- После курса лечения возможно наступление беременности естественным путем, с помощью внутриматочного введения семенной жидкости, методов ЭКО и ИКСИ.
АНА ИЛИ АНТИЦИТОПЛАЗМАТИЧЕСКИЕ АНТИТЕЛА
— системная красная волчанка (СКВ), — ревматоидный артрит,- синдром Шегрена, — склеродермия,- дерматомиозит,- узелковый периартериит и др.;
- Инфекции (туберкулез, инфекционный мононуклеоз, острый и особенно хронический вирусный гепатит, подострый инфекционный эндокардит, ВИЧ-инфекция и др.);
- Хронический аутоиммунный гепатит, первичный билиарный цирроз печени;
- Сахарный диабет (инсулинзависимый);
- Множественный склероз;
- Легочной фиброз;
- Системные васкулиты.
Антинуклеарные антитела также могут выявляться при острых и хронических лейкозах, приобретенной гемолитической анемии, болезни Вальденстрема, малярии, хронической почечной недостаточности, тромбоцитопениях, лимфопролиферативных заболеваниях, миастении и тимомах.Титры антинуклеарных антител при узелковом периартериите могут достигать 1:100, при дерматомиозите — 1:500, СКВ — 1:1000 и выше. При СКВ тест на выявление антинуклеарных антител методом непрямой иммунофлюоресценции обладает высокой степенью чувствительности (до 98% по данным разных авторов), но умеренной специфичностью (78%), так как антинуклеарные антитела могут встречаться и при других, указанных выше, заболеваниях. Для сравнения, тест определения антител к нативной ДНК с помощью ИФА в диагностике СКВ обладает значительно меньшей чувствительностью — 38% (т.к. патогенетическую роль в развитии СКВ могут играть не только антитела к ДНК, но и антитела к гистонам, дезоксирибонуклеопротеину и многим другим ядерным антигенам); однако специфичность определения антител к нативной ДНК для диагноза СКВ является почти абсолютной (98%). Клиническая интерпретация этих различий в чувствительности и специфичности разных лабораторных тестов в диагностике СКВ выглядит следующим образом: отрицательный результат обнаружения антител к нативной ДНК с помощью ИФА не исключает диагноз СКВ, обнаружение же этих антител практически со 100% вероятностью подтверждает диагноз. Другая ситуация имеется в отношении АНФ: отрицательный (особенно многократный) результат обнаружения антинуклеарных антител методом непрямой иммунофлюоресценции делает диагноз СКВ (во всяком случае, активной формы) весьма сомнительным (т.к. метод обнаруживает практически все аутоантитела, встречающиеся при СКВ), обнаружение же антинуклеарных антител не всегда будет достаточным основанием для постановки диагноза СКВ, оно подтверждает наличие феномена аутоиммунитета и обычно требует для установления окончательного диагноза дальнейшей клинико-лабораторной дифференциации с учетом типа свечения, титра антител, проведения дополнительных уточняющих или подтверждающих тестов, рекомендованных лабораторией, сопоставления результатов с клинической картиной.При СКВ корреляция между величиной титра ANA и клиническим состоянием обычно отсутствует, хотя сохранение высоких титров в течение длительного времени является неблагоприятным прогностическим признаком. Снижение уровня антител предвещает ремиссию, но иногда — летальный исход (феномен потребления антител: при нарастающем аутоиммунном повреждении тканей темп высвобождения ядерных антигенов, с которыми связываются наработанные антиядерные антитела, превышает скорость синтеза новых аутоантител).При склеродермии частота выявления антител к ядерным антигенам составляет 60-80%, их титр обычно ниже, чем при СКВ. При ревматоидном артрите часто встречаются СКВ-подобные формы течения, поэтому довольно часто выявляются ANA. При дерматомиозите антитела к ядерным антигенам в крови встречаются в 20-60% случаев, при узелковом периартериите — в 17% (титр до 1:100), при болезни Шегрена — в 56% в сочетании с артритом и в 88% случаев — при комбинации с синдромом Гужеро-Шегрена. При дискоидной (кожной) красной волчанке антинуклеарный фактор выявляется у 50% больных.Частота обнаружения антинуклеарных антител при ревматическихзаболеваниях и у здоровых лиц (Насонова В.А. и др., 1997)
| Заболевание | Частота выявления ANA, % | Титры |
| СКВ — активная форма | 98-100 | +++ |
| Дискоидная красная волчанка | 40 | ++, +++ |
| Лекарственная волчанка | 100 | ++ |
| Системная склеродермия | 70 | ++, +++ |
| Синдром Шегрена | 60 | ++, +++ |
| Смешанное заболевание соединительной ткани | 100 | ++, +++ |
| Болезнь Рейно | 60 | ++, +++ |
| Ревматоидный артрит | 40 | +, ++ |
| Ювенильный хронический артрит | 20 | +, ++ |
| Полимиозит и дерматомиозит | 30 | + |
| Узелковый периартериит | 17 | + |
| Здоровые лица до 40 лет | 3 | + |
| Здоровые лица после 40 лет | 25 | + |
Виды обследования
Волчаночная полоса
Обнаружить антитела в крови удается двумя способами. Первая методика называется непрямая иммунофлуоресцентная микроскопия. При наличии антител они будут связываться со специфическими ядерными антигенами. Используются элементы, которые светятся в отдельном световом спектре. Под микроскопом появляется возможность выявления типа свечения.
Этот способ признан самым лучшим для определения значения антинуклеарных антител. Также методика получила второе название — волчаночные тест-полосы.Вторым методом диагностирования выступает ферментный иммунный анализ. Его смысл заключается в том, что антитела, находящиеся в крови, попадают во взаимосвязь с антигеном и в итоге раствор меняет свой оттенок.
Обязательно назначается дополнительное исследование, с помощью которого удается определить недуг на ранней стадии. В случае отрицательного скрининга можно предполагать полное отсутствие нарушений. Однако и это вовсе не исключает наличия у пациента аутоиммунного заболевания.
Сдается кровь на антинуклеарный фактор совместно с другими анализами. Но на конечный результат оказывает влияние прием некоторых медикаментов и наличие у пациента патологий хронического и острого течения. Разобрать все эти моменты поможет специалист, затем установит верный диагноз и посоветует, как поступить дальше.
Как правильно подготовиться к исследованию
Материалом для анализа выступает венозная кровь.
Особенности подготовки:
Материал берут на голодный желудок. После последней трапезы должно пройти, как минимум, 8 часов
Допустимо пить качественную фильтрованную воду без газа.
Предварительно за два часа перед забором крови исключается курение и использование никотиновых продуктов.
За несколько дней до совершения манипуляции исключается потребление спиртных напитков и энергетиков, запрещено заниматься тяжелым физическим трудом.
За две недели должен полностью исключаться прием фармацевтических средств, в частности, гормонов, антибиотиков и прочих медикаментов.
В целях подтверждения исследования важно повторить скрининг через две недели.
Ожидайте результатов в течение 48 часов после процедуры. Возможно получение данных в экстренном порядке в течение 3 часов.
Ревматоидный фактор
Исследование крови на ревматоидный фактор направлено на выявление специфических антител класса IgM к антителам класса IgG.
Лабораторный тест на ревматоидный фактор является скрининговым исследованием, направленным на выявление аутоиммунных нарушений. Главная задача исследования на ревматоидный фактор – выявление ревматоидного артрита, болезни и синдрома Шегрена и ряда других аутоиммунных болезней.
Анализ на ревматоидный фактор может потребоваться при следующих симптомах:
- боли и отечность в суставах;
- ограничение подвижности в суставах;
- чувство сухости в глазах и во рту;
- кожные высыпания по типу кровоизлияний;
- слабость, упадок сил.
1
Ревматоидный артрит
2
Ревматологическое обследование
3
Ревматологическое обследование
Нормы ревматоидного фактора в крови
Теоретически в здоровом организме ревматоидного фактора быть не должно. Но все же в крови у некоторых даже здоровых людей этот фактор присутствует в небольшом титре. В зависимости от лаборатории верхняя граница нормы ревматодного фактора варьирует от 10 до 25 международных единиц (МЕ) на 1 миллилитр крови.
Ревматоидный фактор одинаковый у женщин и мужчин. У людей пожилого возраста показатель ревматоидного фактора будет несколько выше.
Ревматоидный фактор у ребенка должен составлять в норме 12,5 МЕ на миллилитр.
Анализ на ревматоидный фактор используется для диагностики следующих заболеваний:
- ревматоидный артрит;
- системные аутоиммунные заболевания;
- риоглобулинемия.
Другие причины повышения ревматоидного фактора
Дополнительные причины повышения ревматоидного фактора могут быть следующими:
- сифилис;
- краснуха;
- инфекционный мононуклеоз;
- малярия;
- туберкулез;
- грипп;
- гепатит;
- лейкемия;
- цирроз печени;
- сепсис
Если причина повышенного ревматоидного фактора – инфекционные заболевания, например, инфекционный мононуклеоз, то титр ревматоидного фактора обычно меньше, чем при ревматоидном артрите.
Тем не менее, анализ на ревматоидный фактор прежде всего помогает распознать ревматоидный артрит. Однако следует подчеркнуть, что ставить диагноз лишь на его основании нельзя. Поскольку ревматоидный фактор может быть повышенным при многих других патологических состояниях аутоиммунной и не аутоиммунной природы. Кроме этого, примерно у 30% больных ревматоидным артритом анализ крови на ревматоидный фактор может оказаться отрицательным (серонегативный вариант ревматоидного артрита).
Анализ крови на ревматоидный фактор проводят утром натощак (с последнего приема пищи должно пройти от 8 до 12 часов).
Показания к исследованию
Врач может направить больного на этот анализ при обнаружении следующих изменений состояния его организма:
- длительно сохраняющаяся субфебрильная температура тела (до 37,5 °С), лихорадка неясного генеза;
- похудение на 5 кг и более за 3-6 месяцев без видимой на то причины (образ жизни больного за этот период не стал активнее, чем был, пищевые привычки не изменились);
- увеличение лимфатических узлов неясного генеза;
- боли в суставах, артриты неясной этиологии;
- боли в мышцах, выраженная общая слабость;
- сыпь на коже по типу васкулита;
- патологические изменения со стороны одновременно многих органов и систем;
- высокая СОЭ без видимых на то причин;
- анемия, снижение уровня лейкоцитов и тромбоцитов в периферической крови;
- повышенная концентрация гамма-глобулинов в крови;
- белок в моче (при необходимости уточнить характер поражения почек, причину протеинурии).
Анализ на С-реактивный белок
С-реактивный белок (СРБ) – очень чувствительный элемент анализа крови, который быстро реагирует даже на мельчайшее повреждение ткани организма. Присутствие С-реактивного белка в крови является предвестником воспаления, травмы, проникновения в организм бактерий, грибков, паразитов.
СРБ точнее показывает воспалительный процесс в организме, чем СОЭ (скорость оседания эритроцитов). В то же время С-реактивный белок быстро появляется и исчезает – быстрее, чем изменяется СОЭ.
За способность С-реактивного белка в крови появляться в самый пик заболевания его еще называют «белком острой фазы».
При переходе болезни в хроническую фазу С-реактивный белок снижается в крови, а при обострении процесса повышается вновь.
С-реактивный белок норма
С-реактивный белок производится клетками печени и в сыворотке крови содержится в минимальном количестве. Содержание СРБ в сыворотке крови не зависит от гормонов, беременности, пола, возраста.
Норма С-реактивного белка у взрослых и детей одинаковая – меньше 5 мг/ л (или 0,5 мг/ дл).
Анализ крови на С-реактивный белок берется из вены утром, натощак.
1
Анализ крови на уровень мочевой кислоты
2
анализ крови на антинуклеарные антитела
3
Исследование крови на ревматоидный фактор
Причины повышения С-реактивного белка
С-реактивный белок может быть повышен при наличии следующих заболеваний:
- ревматизм;
- острые бактериальные, грибковые, паразитарные и вирусные инфекции;
- желудочно-кишечные заболевания;
- очаговые инфекции (например, хронический тонзиллит);
- сепсис;
- ожоги;
- послеоперационные осложнения;
- инфаркт миокарда;
- бронхиальная астма с воспалением органов дыхания;
- осложненный острый панкреатит;
- менингит;
- туберкулез;
- опухоли с метастазами;
- некоторые аутоиммунные заболевания (ревматоидный артрит, системный васкулит и др.).
При малейшем воспалении в первые же 6-8 часов концентрация С-реактивного белка в крови повышается в десятки раз. Имеется прямая зависимость между тяжестью заболевания и изменением уровня СРБ. Т.е. чем выше концентрация С-реактивного белка, тем сильнее развивается воспалительный процесс.
Поэтому изменение концентрации С-реактивного белка используется для мониторинга и контроля эффективности лечения бактериальных и вирусных инфекций.
Разные причины приводят к разному повышению уровня С-реактивного белка:
- Наличие бактериальных инфекций хронического характера и некоторых системных ревматических заболеваний повышает С-реактивный белок до 10-30 мг/л. При вирусной инфекции (если нет травмы) уровень СРБ повышается незначительно. Поэтому высокие его значения указывают на наличие бактериальной инфекции.
- При подозрении на сепсис новорожденных уровень СРБ 12 мг/л и более говорит о необходимости срочной противомикробной терапии.
- При острых бактериальных инфекциях, обострении некоторых хронических заболеваний, остром инфаркте миокарда и после хирургических операциях самый высокий уровень СРБ – от 40 до 100 мг/л. При правильном лечении концентрация С-реактивного белка снижается уже в ближайшие дни, а если этого не произошло, необходимо обсудить другое антибактериальное лечение. Если за 4-6 дней лечения значение СРБ не уменьшилось, а осталось прежним и даже увеличилось, это указывает на появление осложнений (пневмония, тромбофлебит, раневой абсцесс и др.). После операции СРБ будет тем выше, чем тяжелее была операция.
- При инфаркте миокарда белок повышается через 18-36 часов после начала заболевания, через 18-20 дней снижается и к 30-40 дню приходит к норме. При стенокардии он остается в норме.
- При различных опухолях повышение уровня С-реактивного белка может служить тестом для оценки прогрессирования опухолей и рецидива заболевания.
- Тяжелые общие инфекции, ожоги, сепсис повышают С-реактивный белок до огромнейших значений: до 300 мг/л и более.
- При правильном лечении уровень С-реактивного белка снижается уже на 6-10 день.
Подготовка к ревматологическим анализам
Чтобы анализы показывали объективную информацию, необходимо придерживаться некоторых правил. Сдавать кровь нужно в утренние часы, натощак. Между взятием анализов и приемом пищи должно пройти приблизительно 12 часов. Если мучает жажда, выпейте немного воды, но не сок, чай или кофе. Необходимо исключить интенсивные физические упражнения, стрессы. Нельзя курить и употреблять спиртное.
Подготовка
Забор биоматериала осуществляется в утренние часы. Сдавать кровь необходимо натощак. Последний прием пищи должен быть совершен минимум за 4 часа. При этом пить воду допустимо в любое время и в любых количествах. Под запретом употребление алкоголя.
За 1 день до исследования показан покой. Физические и психоэмоциональные нагрузки нередко приводят к ложному результату. За полчаса до сдачи крови запрещено курить.
Необходимо поставить в известность врача о принимаемых медикаментах во время назначения им анализа АНФ. Это обусловлено тем, что активные компоненты некоторых препаратов провоцируют выработку антител и также могут стать причиной лекарственной волчанки. Ложноотрицательные результаты нередко являются следствием приема глюкокортикостероидов.
Если пациенту были назначены физиопроцедуры или инструментальные обследования, их необходимо проводить только после сдачи крови.
Описание
Анализ АНА — это самый информативный метод постановки диагноза при подозрении на любые аутоиммунные расстройства, в основном, это заболевания соединительной ткани. Но встречаются также наличие антител при злокачественных процессах, инфекционных и т.д.
Самая большая чувствительность антител к таким недугам:
- Системной красной волчанки.
- Ревматоидному артриту.
- Болезни Шегрена.
Эти клетки могут быть обнаружены также примерно у трети пациентов, страдающих хронической формой гепатита. На увеличение показателей влияют разные факторы. В частности, малярия, лейкоз, инфекционный мононуклеоз и многое другое.
Вместе с выявлением АНА при выполнении исследования важно оценить уровень содержания таких иммуноглобулинов, как IgA, IgM, IgG. Выявление данных составляющих в крови у пациентов может указывать на большие шансы появления ревматических патологий и коллагенозов
Если же взаимосвязь между содержанием антител и симптомами не была выявлена, само наличие АНА в крови указывает на выбор правильной тактики лечения. Длительное сохранение высоких титров говорит о неутешительном положении дел. Понижение этих титров говорит о ремиссии патологии, гораздо реже о скорой смерти.
Вместе с тем данные антитела могут быть выявлены у определенного процента здоровых лиц и титры АНФ могут выходить за пределы нормы.
Виды обследования
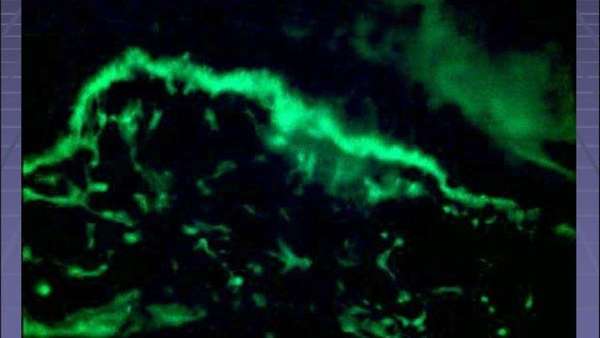
Обнаружить антитела в крови удается двумя способами. Первая методика называется непрямая иммунофлуоресцентная микроскопия. При наличии антител они будут связываться со специфическими ядерными антигенами. Используются элементы, которые светятся в отдельном световом спектре. Под микроскопом появляется возможность выявления типа свечения.
Этот способ признан самым лучшим для определения значения антинуклеарных антител. Также методика получила второе название — волчаночные тест-полосы. Вторым методом диагностирования выступает ферментный иммунный анализ. Его смысл заключается в том, что антитела, находящиеся в крови, попадают во взаимосвязь с антигеном и в итоге раствор меняет свой оттенок.
Обязательно назначается дополнительное исследование, с помощью которого удается определить недуг на ранней стадии. В случае отрицательного скрининга можно предполагать полное отсутствие нарушений. Однако и это вовсе не исключает наличия у пациента аутоиммунного заболевания.
Сдается кровь на антинуклеарный фактор совместно с другими анализами. Но на конечный результат оказывает влияние прием некоторых медикаментов и наличие у пациента патологий хронического и острого течения. Разобрать все эти моменты поможет специалист, затем установит верный диагноз и посоветует, как поступить дальше.
Как правильно подготовиться к исследованию
Материалом для анализа выступает венозная кровь.
Особенности подготовки:
Материал берут на голодный желудок. После последней трапезы должно пройти, как минимум, 8 часов. Допустимо пить качественную фильтрованную воду без газа. Предварительно за два часа перед забором крови исключается курение и использование никотиновых продуктов.
За несколько дней до совершения манипуляции исключается потребление спиртных напитков и энергетиков, запрещено заниматься тяжелым физическим трудом.
За две недели должен полностью исключаться прием фармацевтических средств, в частности, гормонов, антибиотиков и прочих медикаментов
В целях подтверждения исследования важно повторить скрининг через две недели.
Ожидайте результатов в течение 48 часов после процедуры. Возможно получение данных в экстренном порядке в течение 3 часов.