Белки
Содержание:
- 3. Внутриклеточные регуляторные белки
- Роль белков
- Что мы узнали?
- Основные функции
- Как устроен белок?
- Структурная функция
- Зачем организму белок?
- Конечный этап синтеза белков в клетках
- Пространственная организация белковых молекул
- Где больше всего содержится белка
- Свойства белков
- Функции белков
- Химическая защита
- Внутриклеточные регуляторные белки
- Функции белков в организме
- Как происходит денатурации белка
3. Внутриклеточные регуляторные белки
Белки регулируют процессы, происходящие внутри клеток, при помощи нескольких механизмов:
- взаимодействия с молекулами ДНК (транскрипционные факторы)
- при помощи фосфорилирования (протеинкиназы) или дефосфорилирования (протеинфосфатазы) других белков
- при помощи взаимодействия с рибосомой или молекулами РНК (факторы регуляции трансляции)
- воздействия на процесс удаления интронов (факторы регуляции сплайсинга)
- влияния на скорость распада других белков (убиквитины и др.)
3.1. Белки-регуляторы транскрипции
Транскрипционный фактор
— это белок, который, попадая в ядро, регулирует транскрипцию ДНК, то есть считывание информации с ДНК на мРНК (синтез мРНК по матрице ДНК). Некоторые транскрипционные факторы изменяют структуру хроматина, делая его более доступным для РНК-полимераз. Существуют различные вспомогательные транскрипционные факторы, которые создают нужную конформацию ДНК для последующего действия других транскрипционных факторов. Еще одна группа транскрипционных факторов — это те факторы, которые не связываются непосредственно с молекулами ДНК, а объединяются в более сложные комплексы с помощью белок-белковых взаимодействий.
3.2. Факторы регуляции трансляции
Трансляция
— синтез полипептидных цепей белков по матрице мРНК, выполняемый рибосомами. Регуляция трансляции может осуществляться несколькими способами, в том числе и с помощью белков-репрессоров, которые, связываются с мРНК. Известно много случаев, когда репрессором является белок, который кодируется этой мРНК. В этом случае происходит регуляция по типу обратной связи (примером этого может служить репрессия синтеза фермента треонил-тРНК-синтетазы).
3.3. Факторы регуляции сплайсинга
Внутри генов эукариот есть участки, не кодирующие аминокислот. Эти участки называются интронами. Они сначала переписываются на пре-мРНК при транскрипции, но затем вырезаются особым ферментом. Этот процесс удаления интронов, а затем последующее сшивание концов оставшихся участков называют сплайсингом (сшивание, сращивание). Сплайсинг осуществляется с помощью небольших РНК, обычно связанных с белками, которые называются факторами регуляции сплайсинга. В сплайсинге принимают участие белки, обладающие ферментативной активностью. Они придают пре-мРНК нужную конформацию. Для сборки комплекса(сплайсосомы) необходимо потребление энергии в виде расщепляемых молекул АТФ, поэтому в составе этого комплекса есть белки, обладающие АТФ-азной активностью.
Существует альтернативный сплайсинг. Особенности сплайсинга определяются белками, способными связываться с молекулой РНК в областях интронов или участках на границе экзон-интрон. Эти белки могут препятствовать удалению одних интронов и в то же время способствовать вырезанию других. Направленная регуляция сплайсинга может иметь значительные биологические последствия. Например, у плодовой мушки дрозофилы альтернативный сплайсинг лежит в основе механизма определения пола.
3.4. Протеинкиназы и протеинфосфатазы
Важнейшую роль в регуляции внутриклеточных процессов играют протеинкиназы — ферменты, которые активируют или подавляют активность других белков путем присоединения к ним фосфатных групп.
Протеинкиназы регулируют активность других белков путем фосфолирования — присоединения остатков фосфорной кислоты к остаткам аминокислот, имеющих гидроксильные группы. При фосфорилировании обычно изменяется функционирование данного белка, например, ферментативная активность, а также положение белка в клетке.
Существуют также протеинфосфатазы — белки,которые отщепляют фосфатные группы. Протеинкиназы и протеинфосфатазы регулируют обмен веществ, а также передачу сигналов внутри клетки. Фосфорилирование и дефосфорилирования белков — один из главным механизмов регуляции большинства внутриклеточных процессов.
Цикл активации G-белка под действием рецептора.
Синхронизация выполнена 18.07.11 07:59:14
Роль белков
Большинство биологически активных веществ (гормоны, ферменты) являются белками. Основные биологические функции белков описаны в таблице.
| Функция | Описание | Примеры белков |
| Структурная | Являются «строительным материалом». Входят в состав клеточных мембран, органелл, хрящей, сухожилий, волос, кровеносных сосудов | Кератин, коллаген, эластин |
| Двигательная | Сокращают мышцы, обеспечивают движение жгутиков, хромосом при митозе, органов растений | Актин, миозин |
| Транспортная | Переносят молекулы веществ при дыхании и метаболизме, обеспечивают взаимосвязь каждой клетки с внешней средой | Гемоглобин, миоглобин, транскортин |
| Защитная | Обеспечивают свёртываемость крови, предохраняют организм от инфекций и чужеродных частиц, поддерживают иммунитет | Иммуноглобулины, тромбин, фибриноген |
| Рецепторная | Принимают, задерживают и передают сигналы из внешней среды в клетку | Опсин, фитохром, протеинкиназа |
| Регуляторная | Регулируют обмен веществ, контролируют рост, развитие, размножение | Глюкагон, тироксин, соматотропин |
| Ферментативная | Участвуют в биохимических реакциях, ускоряя их протекание | Трипсин, пепсин, амилаза, липаза, каталаза |
| Запасающая | Запасают в организме различные жизненно важные элементы – железо, кислород и т.д. | Альбумин, глютен, ферритин |
| Энергетическая | При длительном голодании могут использоваться в качестве энергии. Расщепление грамма белка даёт 17,6 кДж энергии | Любой белок организма |
Белки, в зависимости от выполняемой функции, могут быть встроенными, поверхностными, свободными. Например, глобулярные белки, интегрированные в клеточную мембрану, выполняют транспортную или рецепторную функцию.

Рис. 3. Белки, встроенные в мембрану.
Что мы узнали?
Из урока биологии 10 класса кратко узнали о строении и основных функциях белка. Белки состоят из аминокислот. В зависимости от назначения выделяют рецепторные, структурные, регуляторные, ферментативные, двигательные и другие белки.
-
Вопрос 1 из 5
Начать тест(новая вкладка)
Основные функции
Принято выделять 11 функций белка:
- Транспортная.
- Строительная
- Регуляторная.
- Защитная.
- Двигательная.
- Сигнальная.
- Запасающая.
- Энергетическая.
- Каталитическая или ферментативная.
- Функция антифриза.
- Резервная или питательная.
Транспортная
Уникальная способность белков заключается в их умении присоединять различные вещества и транспортировать их к тем или иным тканям и органам:
- гемоглобин — белок в крови. Присоединяет к себе кислород и переносит его от легких ко всем органам и тканям, а от них забирает углекислый газ и перевозит обратно в легкие;
- липопротеины (от греческого lípos (Λίπος) — «жир», proteḯni (πρωτεΐνη) — «белок»). Отвечают за транспортировку жира;
- гаптоглобин. Связывает гемоглобин, попадающий в кровь при повреждении эритроцитов, и свободный гемоглобин, образуя комплекс гемоглобин-гаптоглобин. Он поглощается и утилизируется клетками печени. Печень возвращает организму аминокислоты глобина и железо гема;
- трансферрин. Вырабатывается в печени, связывает железо и переносит его по телу.
Белки выступают трансфером ионов кальция, магния, железа, меди и др.
Строительная
Белки участвуют в образовании клеточных и внеклеточных составов:
кератин. Основной компонент в составе волос, ногтей, перьев или копыт;
- коллаген. Главный элемент сухожилий и хрящей;
- эластин. Входит в состав связок;
- белки клеточных мембран. В основном это гликопротеины.
Регуляторная
Существует отдельная, довольно крупная группа белков, которая ориентируется на регулирование процессов обмена веществ. В этом принимают участие особые гормоны белковой природы. К примеру, инсулин, который контролирует уровень глюкозы в крови и способствует синтезу гликогена.
Защитная
Включается в случае проникновения в организм чужеродных белков или других микроорганизмов, антигенов. В ответ на нападение образуются специальные белки, антитела, которые выполняют функцию обезвреживания нежелательных веществ.
При кровотечении помогает фибрин, способствующий свертыванию крови.
Двигательная
Белки актин и миозин необходимы для сокращения мышц у многоклеточных организмов и других подвижных функций живых существ.
Сигнальная
На клетках есть мембраны, в которые встроены особые рецепторы. Это белки, которые могут изменять свою третичную структуру в зависимости от внешней среды. Так осуществляется передача команд из внешней среды в клетку.
Запасающая
В случаях длительного голодания организм животных или человека использует белки мышц, эпителиальных тканей и печени для поддержания жизнедеятельности организма.
Кроме того, белки участвуют в откладывании в качестве запаса некоторых веществ. Таким веществом может бы железо, которое не выводится из организма при распаде гемоглобина, а образует комплекс с белком ферритином.
Энергетическая
В качестве источника энергии белки — очень дорогостоящий продукт для нашего тела. Он используется в последнюю очередь, когда израсходованы все углеводы и жиры. При распаде 1 грамма белка выделяется 17,6 кДж энергии. Первым делом они распадаются до аминокислот, а потом до конечных продуктов: воды, углекислого газа и аммиака.
Каталитическая (ферментативная)
Одна из самых важных для организма функций осуществляется за счет особых белков, ферментов (биохимических катализаторов). Они ускоряют биохимические реакции в клетках.
Ферменты можно разделить на:
- Простые. Состоят исключительно из аминокислот.
- Сложные. Помимо белковой части в их состав входит группа небелкового происхождения (кофактор). У некоторых ферментов эту роль играют витамины.
Функция антифриза
У некоторых существ в плазме крови есть белки, которые предупреждают ее замерзание. Такая способность белка является необходимой для выживания в условиях экстремально низких температур.
Питательная (резервная)
Ее выполняют резервные белки, которые становятся для плода источниками питания. В качестве примера можно привести белки яйца (овальбумины) или основной белок молока (казеин).
Как устроен белок?
Молекула белка представляет собой спираль, которая состоит из аминокислотных остатков (аминокислот). Всего в природе насчитывают около 80 аминокислот, но для человеческого организма интересны всего 22 аминокислоты, из которых 12 – это заменимые аминокислоты и 10 – незаменимые. Так вот именно незаменимые аминокислоты представляет для нас наибольший интерес. Сейчас объясню почему.
Для человека очень важно, чтобы с пищей он потреблял все незаменимые аминокислоты, так как они не синтезируются в нашем организме самостоятельно! В этом и есть их главное отличие от заменимых аминокислот. Если наш организм не получает хоть одну незаменимую аминокислоту, то это может стать причиной многих проблем со здоровьем, из-за чего не стоит недооценивать
В первую очередь нам интересны белки, которые по своему аминокислотному составу являются полноценными. Полноценные белки
– это белки, в составе которых присутствуют все незаменимые аминокислоты. Если же в белке отсутствует хотя бы одна незаменимая аминокислота или она представлена в недостаточном количестве, то такой белок считается уже неполноценным.
Итак, какие же продукты представлены полноценным белком, а какие нет?
Полноценные белки
– это в первую очередь белки животного происхождения: яйца, мясо животных, мясо рыбы, морепродукты, молочные продукты и соя (единственный растительный белок, который полностью полноценный).
Неполноценные белки
– это белки растительного происхождения: орехи, бобовые, крупы и некоторые овощи.
Чтобы наш организм работал, как часы, а наша иммунная система была крепкой, нам нужно так выстроить свой суточный рацион питания, чтоб 60% всех потребляемых белков за день были ПОЛНОЦЕННЫМИ, а именно ЖИВОТНОГО происхождения!
А теперь давайте рассмотрим основные функции белков в нашем организме
.
Структурная функция
В организме, помимо высокоспециализированных, существуют еще и структурные белки. Они необходимы, чтобы обеспечивать механическую прочность. Эти функции белков в клетке важны для поддержания формы и сохранения молодости организма. Самым известным является коллаген. Это основной белок внеклеточного матрикса соединительных тканей. У высших млекопитающих он составляет до 1/4 общей массы белков. Синтезируется коллаген в фибробластах, которые являются основными клеточками соединительных тканей.
Такие функции белков в клетке имеют огромное значение. Помимо коллагена, известен еще один структурный белок – эластин. Он также является составляющей внеклеточного матрикса. Эластин способен наделять ткани возможностью растягиваться в определенных пределах и легко возвращаться в исходную форму. Еще один пример структурного белка – фиброин, который обнаружен у гусениц шелкопрядов. Это основной компонент шелковых нитей.
Зачем организму белок?
Замечено, что в питании значительной части населения наблюдается дефицит трех незаменимых аминокислот: лизина, метионина, триптофана — и производной последнего — серотонина. Многие задаются вопросом о том, зачем организму белок в большом количестве, если происходит процесс похудания. И это очень опасная ошибка. Продукты животного происхождения гораздо богаче указанными веществами. Поэтому животные белки не только хорошо усваиваются, но и существенно улучшают усвоение растительных белков, что позволяет сбалансировать аминокислотный состав пищи во время еды. Нельзя исключать из рациона мясо, даже если вы очень сильно стремитесь похудеть.
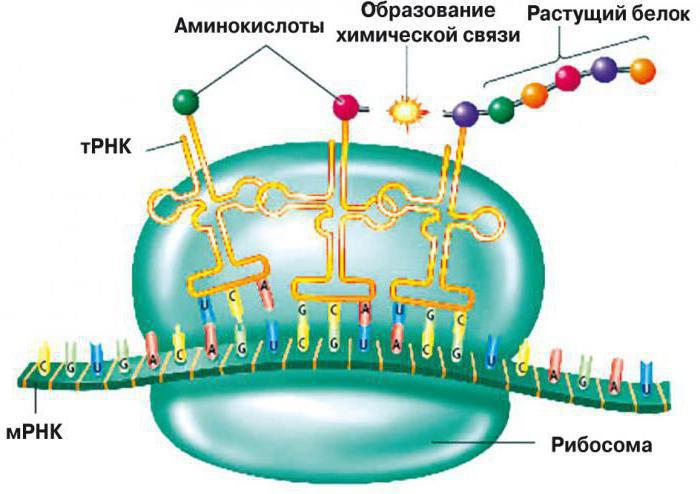
Конечный этап синтеза белков в клетках
Аминокислоты плавают в цитоплазме так же, как и транспортные РНК, и когда происходит непосредственно сборка полипептидной цепи, эти транспортные РНК начинают с ними соединяться. Однако не во всякой последовательности и далеко не любая транспортная РНК может соединиться со всеми видами аминокислот. Существует определенный участок, к которому присоединяется необходимая аминокислота. Второй же участок транспортной РНК называется антикодоном. Этот элемент состоит из трех нуклеотидов, которые комплементарны последовательности нуклеотидов в информационной РНК. Для одной аминокислоты необходимо три нуклеотида. Например, какой-либо условный белок состоит для упрощения из всего лишь двух аминокислот. Очевидно, что в основном белки имеют очень длинную структуру, состоят из многих аминокислот. Цепь А — Г — У называется триплетом, или кодоном, к нему будет присоединяться транспортная РНК в виде клевера, на конце которого будет находиться определенная аминокислота. К следующему триплету Ц — У — А будет присоединяться еще одна тРНК, которая будет содержать совершенно другую аминокислоту, комплементарную данной последовательности. В таком порядке будет происходить дальнейшая сборка полипептидной цепочки.
Пространственная организация белковых молекул
Выполнение белками определенных специфических функций зависит от пространственной конфигурации их молекул, кроме того, клетке энергетически невыгодно держать белки в развернутой форме, в виде цепочки, поэтому полипептидные цепи подвергаются укладке, приобретая определенную трехмерную структуру, или конформацию. Выделяют 4 уровня пространственной организации белков.
Первичная структура белка — последовательность расположения аминокислотных остатков в полипептидной цепи, составляющей молекулу белка. Связь между аминокислотами — пептидная.
Если молекула белка состоит всего из 10 аминокислотных остатков, то число теоретически возможных вариантов белковых молекул, отличающихся порядком чередования аминокислот, — 1020. Имея 20 аминокислот, можно составить из них еще большее количество разнообразных комбинаций. В организме человека обнаружено порядка десяти тысяч различных белков, которые отличаются как друг от друга, так и от белков других организмов.
Именно первичная структура белковой молекулы определяет свойства молекул белка и ее пространственную конфигурацию. Замена всего лишь одной аминокислоты на другую в полипептидной цепочке приводит к изменению свойств и функций белка. Например, замена в β-субъединице гемоглобина шестой глутаминовой аминокислоты на валин приводит к тому, что молекула гемоглобина в целом не может выполнять свою основную функцию — транспорт кислорода; в таких случаях у человека развивается заболевание — серповидноклеточная анемия.
Вторичная структура — упорядоченное свертывание полипептидной цепи в спираль (имеет вид растянутой пружины). Витки спирали укрепляются водородными связями, возникающими между карбоксильными группами и аминогруппами. Практически все СО- и NН-группы принимают участие в образовании водородных связей. Они слабее пептидных, но, повторяясь многократно, придают данной конфигурации устойчивость и жесткость. На уровне вторичной структуры существуют белки: фиброин (шелк, паутина), кератин (волосы, ногти), коллаген (сухожилия).
Третичная структура — укладка полипептидных цепей в глобулы, возникающая в результате возникновения химических связей (водородных, ионных, дисульфидных) и установления гидрофобных взаимодействий между радикалами аминокислотных остатков. Основную роль в образовании третичной структуры играют гидрофильно-гидрофобные взаимодействия. В водных растворах гидрофобные радикалы стремятся спрятаться от воды, группируясь внутри глобулы, в то время как гидрофильные радикалы в результате гидратации (взаимодействия с диполями воды) стремятся оказаться на поверхности молекулы. У некоторых белков третичная структура стабилизируется дисульфидными ковалентными связями, возникающими между атомами серы двух остатков цистеина. На уровне третичной структуры существуют ферменты, антитела, некоторые гормоны.
Четвертичная структура характерна для сложных белков, молекулы которых образованы двумя и более глобулами. Субъединицы удерживаются в молекуле благодаря ионным, гидрофобным и электростатическим взаимодействиям. Иногда при образовании четвертичной структуры между субъединицами возникают дисульфидные связи. Наиболее изученным белком, имеющим четвертичную структуру, является гемоглобин. Он образован двумя α-субъединицами (141 аминокислотный остаток) и двумя β-субъединицами (146 аминокислотных остатков). С каждой субъединицей связана молекула гема, содержащая железо.
Если по каким-либо причинам пространственная конформация белков отклоняется от нормальной, белок не может выполнять свои функции. Например, причиной «коровьего бешенства» (губкообразной энцефалопатии) является аномальная конформация прионов — поверхностных белков нервных клеток.
Где больше всего содержится белка
Также стоит разобраться, где больше всего содержится белка в продуктах растительного происхождения. Самые ценные из растительных белков содержатся в гречихе, бобовых, картофеле, рисе и ржаном хлебе.
Сравнительно выгодны в данном отношении мучные изделия с творогом (вареники, сочники) или мясом (пельмени, пирожки с мясом и т. д.), тогда как сочетание теста с рисом и другими крупами менее оправданно.
Биологическая ценность белков возрастает при сочетании зерновых, бобовых и мясомолочных продуктов. Для повышения белковой полноценности питания выпускают хлебобулочные изделия, обогащенные обезжиренным молоком или молочной сывороткой, яичные и молочные макаронные изделия. Также существуют специальные сухие концентраты с высоким содержанием легкоусвояемых белков, используемые для питания тяжелобольных.
Впрочем, в отдельных случаях возникает необходимость ограничить потребление белка, например при недостаточности почек или печени. Для этого используют специальные малобелковые крупяные, макаронные и хлебобулочные изделия.
Свойства белков
Купить проверочные работы по биологии
Аминокислотный состав, структура белковой молекулы определяют его свойства. Белки сочетают в себе основные и кислотные свойства, определяемые радикалами аминокислот: чем больше кислых аминокислот в белке, тем ярче выражены его кислотные свойства. Способность отдавать и присоединять Н+ определяют буферные свойства белков; один из самых мощных буферов — гемоглобин в эритроцитах, поддерживающий рН крови на постоянном уровне. Есть белки растворимые (фибриноген), есть нерастворимые, выполняющие механические функции (фиброин, кератин, коллаген). Есть белки активные в химическом отношении (ферменты), есть химически неактивные, устойчивые к воздействию различных условий внешней среды и крайне неустойчивые.
Внешние факторы (нагревание, ультрафиолетовое излучение, тяжелые металлы и их соли, изменения рН, радиация, обезвоживание)
могут вызывать нарушение структурной организации молекулы белка. Процесс утраты трехмерной конформации, присущей данной молекуле белка, называют денатурацией. Причиной денатурации является разрыв связей, стабилизирующих определенную структуру белка. Первоначально рвутся наиболее слабые связи, а при ужесточении условий и более сильные. Поэтому сначала утрачивается четвертичная, затем третичная и вторичная структуры. Изменение пространственной конфигурации приводит к изменению свойств белка и, как следствие, делает невозможным выполнение белком свойственных ему биологических функций. Если денатурация не сопровождается разрушением первичной структуры, то она может быть обратимой, в этом случае происходит самовосстановление свойственной белку конформации. Такой денатурации подвергаются, например, рецепторные белки мембраны. Процесс восстановления структуры белка после денатурации называется ренатурацией. Если восстановление пространственной конфигурации белка невозможно, то денатурация называется необратимой.
Функции белков
| Функция | Примеры и пояснения |
|---|---|
| Строительная | Белки участвуют в образовании клеточных и внеклеточных структур: входят в состав клеточных мембран (липопротеины, гликопротеины), волос (кератин), сухожилий (коллаген) и т.д. |
| Транспортная | Белок крови гемоглобин присоединяет кислород и транспортирует его от легких ко всем тканям и органам, а от них в легкие переносит углекислый газ; в состав клеточных мембран входят особые белки, которые обеспечивают активный и строго избирательный перенос некоторых веществ и ионов из клетки во внешнюю среду и обратно. |
| Регуляторная | Гормоны белковой природы принимают участие в регуляции процессов обмена веществ. Например, гормон инсулин регулирует уровень глюкозы в крови, способствует синтезу гликогена, увеличивает образование жиров из углеводов. |
| Защитная | В ответ на проникновение в организм чужеродных белков или микроорганизмов (антигенов) образуются особые белки — антитела, способные связывать и обезвреживать их. Фибрин, образующийся из фибриногена, способствует остановке кровотечений. |
| Двигательная | Сократительные белки актин и миозин обеспечивают сокращение мышц у многоклеточных животных. |
| Сигнальная | В поверхностную мембрану клетки встроены молекулы белков, способных изменять свою третичную структуру в ответ на действие факторов внешней среды, таким образом осуществляя прием сигналов из внешней среды и передачу команд в клетку. |
| Запасающая | В организме животных белки, как правило, не запасаются, исключение: альбумин яиц, казеин молока. Но благодаря белкам в организме могут откладываться про запас некоторые вещества, например, при распаде гемоглобина железо не выводится из организма, а сохраняется, образуя комплекс с белком ферритином. |
| Энергетическая | При распаде 1 г белка до конечных продуктов выделяется 17,6 кДж. Сначала белки распадаются до аминокислот, а затем до конечных продуктов — воды, углекислого газа и аммиака. Однако в качестве источника энергии белки используются только тогда, когда другие источники (углеводы и жиры) израсходованы. |
| Каталитическая | Одна из важнейших функций белков. Обеспечивается белками — ферментами, которые ускоряют биохимические реакции, происходящие в клетках. Например, рибулезобифосфаткарбоксилаза катализирует фиксацию СО2 при фотосинтезе. |
Химическая защита
Защитная функция белков проявляется и в химической борьбе с болезнетворными веществами. И начинается она уже в ротовой полости. Попадая в нее, пища вызывает рефлекторное выделение слюны. Основу этого вещества составляет вода, ферменты, которые расщепляют полисахариды и лизоцим. Именно последнее вещество обезвреживает вредоносные молекулы, защищая организм от их дальнейшего воздействия. Содержится он и в слизистых оболочках желудочно-кишечного тракта, и в слезной жидкости, которая омывает роговицу глаза. В большом количестве лизоцим находится в грудном молоке, слизи носоглотки и белке куриных яиц.
Итак, защитная функция белков проявляется в первую очередь в обезвреживании бактериальных и вирусных частиц в крови организма. В результате у него формируется способность противостоять болезнетворным агентам. Ее и называют иммунитетом. Белки, которые входят в состав наружного и внутреннего скелета, защищают внутреннее содержимое от механических повреждений. А белковые вещества, находящиеся в слюне и других средах, предотвращают действие на организм химических агентов. Другими словами, защитная функция белков заключается в обеспечении необходимых условий для всех процессов жизнедеятельности.
Работа нашего организма — чрезвычайно сложный процесс, в котором задействованы миллионы клеток, тысячи самых разнообразных веществ. Но есть одна область, которая целиком и полностью зависит от особых белков, без которых жизнь человека или животного окажется совершенно невозможной. Как вы наверняка догадались, говорим мы сейчас о ферментах.
Сегодня нами будет рассмотрена ферментативная Это важнейшая область биохимии.
Так как в основе этих веществ лежат преимущественно белки, то они сами могут считаться ими. Нужно знать, что впервые ферменты были открыты еще в 30-е годы 19-го века, вот только ученым понадобилось более века, дабы прийти к более-менее единому определению для них. Так какую функцию выполняют белки-ферменты? Об этом, а также об их строении и примерах реакций вы узнаете из нашей статьи.
Нужно понимать, что далеко не всякий белок может быть ферментом даже теоретически. Только белки глобулярной формы способны проявлять каталитическую активность в отношении других органических соединений. Как и все природные соединения этого класса, ферменты состоят из аминокислотных остатков. Запомните, что ферментативная функция белков (примеры которой будут в статье) может выполняться только теми из них, чья молярная масса не меньше 5000.
Внутриклеточные регуляторные белки
Белки регулируют процессы, происходящие внутри клеток, при помощи нескольких механизмов:
- взаимодействия с молекулами ДНК (транскрипционные факторы);
- при помощи фосфорилирования (протеинкиназы) или дефосфорилирования (протеинфосфатазы) других белков;
- при помощи взаимодействия с рибосомой или молекулами РНК (факторы регуляции трансляции);
- воздействия на процесс удаления интронов (факторы регуляции сплайсинга);
- влияния на скорость распада других белков (убиквитины и др.).
Белки-регуляторы транскрипции
Транскрипционный фактор
— это белок, который, попадая в ядро , регулирует транскрипцию ДНК, то есть считывание информации с ДНК на мРНК (синтез мРНК по матрице ДНК). Некоторые транскрипционные факторы изменяют структуру хроматина, делая его более доступным для РНК-полимераз. Существуют различные вспомогательные транскрипционные факторы, которые создают нужную конформацию ДНК для последующего действия других транскрипционных факторов. Еще одна группа транскрипционных факторов — это те факторы, которые не связываются непосредственно с молекулами ДНК, а объединяются в более сложные комплексы с помощью белок-белковых взаимодействий.
Факторы регуляции трансляции
Трансляция
— синтез полипептидных цепей белков по матрице мРНК, выполняемый рибосомами. Регуляция трансляции может осуществляться несколькими способами, в том числе и с помощью белков-репрессоров, которые, связываются с мРНК. Известно много случаев, когда репрессором является белок, который кодируется этой мРНК. В этом случае происходит регуляция по типу обратной связи (примером этого может служить репрессия синтеза фермента треонил-тРНК-синтетазы).
Факторы регуляции сплайсинга
Внутри генов эукариот есть участки, не кодирующие аминокислот. Эти участки называются интронами . Они сначала переписываются на пре-мРНК при транскрипции, но затем вырезаются особым ферментом. Этот процесс удаления интронов, а затем последующее сшивание концов оставшихся участков называют сплайсингом (сшивание, сращивание). Сплайсинг осуществляется с помощью небольших РНК, обычно связанных с белками, которые называются факторами регуляции сплайсинга. В сплайсинге принимают участие белки, обладающие ферментативной активностью. Они придают пре-мРНК нужную конформацию. Для сборки комплекса (сплайсосомы) необходимо потребление энергии в виде расщепляемых молекул АТФ, поэтому в составе этого комплекса есть белки, обладающие АТФ-азной активностью.
Существует альтернативный сплайсинг . Особенности сплайсинга определяются белками, способными связываться с молекулой РНК в областях интронов или участках на границе экзон-интрон. Эти белки могут препятствовать удалению одних интронов и в то же время способствовать вырезанию других. Направленная регуляция сплайсинга может иметь значительные биологические последствия. Например, у плодовой мушки
Существуют
несколько видов защитных функций белков:
Физическая
защита. В ней принимает участие коллаген —
белок, образующий основу межклеточного
вещества соединительных тканей (в том
числе костей, хряща, сухожилий и глубоких
слоёв кожи (дермы)); кератин,
составляющий основу роговых щитков,
волос, перьев, рогов и др. производныхэпидермиса.
Обычно такие белки рассматривают как
белки со структурной функцией. Примерами
этой группы белков служат фибриногены итромбины ,
участвующие в свёртывании крови.
Химическая
защита. Связывание токсинов белковыми
молекулами может обеспечивать их
детоксикацию. Особенно важную роль в
детоксикации у человека играют ферменты печени,
расщепляющие яды или переводящие их в
растворимую форму, что способствует
их быстрому выведению из организма .
Иммунная
защита. Белки, входящие в состав крови и
других биологических жидкостей,
участвуют в защитном ответе организма
как на повреждение, так и на атаку патогенов.
Белки системы
комплемента и антитела (иммуноглобулины)
относятся к белкам второй группы; они
нейтрализуют бактерии, вирусы или
чужеродные белки. Антитела, входящие
в состав адаптативной
иммунной системы,
присоединяются к чужеродным для данного
организма веществам, антигенам,
и тем самым нейтрализуют их, направляя
к местам уничтожения. Антитела
могутсекретироваться в
межклеточное пространство или
закрепляться в мембранах
специализированных В-лимфоцитов,
которые называютсяплазмоцитами .
В то время как ферменты имеют ограниченное
сродство к субстрату, поскольку слишком
сильное присоединение к субстрату
может мешать протеканию катализируемой
реакции, стойкость присоединения
антител к антигену ничем не ограничена .
Функции белков в организме
Различные виды белков, углеводов, жиров являются жизненно необходимыми компонентами для нормальной жизнедеятельности любой клетки. А значит и всего организма в целом. Поэтому во многом их роль объясняется высокой степенью значимости и повсеместной распространенности внутри живых существ. Можно выделить несколько основных функций полипептидных молекул.
- Каталитическая. Ее осуществляют ферменты, которые имеют белковую природу строения. О них скажем позже.
- Структурная. Виды белков и их функции в организме прежде всего влияют на структуру самой клетки, ее форму. Кроме того, полипептиды, выполняющие эту роль, образуют волосы, ногти, раковины моллюсков, перья птиц. Они же являются определенной арматурой в теле клетки. Хрящи состоят также из этих видов белков. Примеры: тубулин, кератин, актин и другие.
- Регуляторная. Данная функция проявляется в участии полипептидов в таких процессах, как: транскрипция, трансляция, клеточный цикл, сплайсинг, считывание мРНК и прочих. Во всех них они играют важную роль регулировщика.
- Сигнальная. Данную функцию выполняют белки, находящиеся на мембране клеток. Они передают различные сигналы от одной единицы к другой, и это приводит к сообщению тканей между собой. Примеры: цитокины, инсулин, факторы роста и прочие.
- Транспортная. Некоторые виды белков и их функции, которые они выполняют, являются просто жизненно необходимыми. Так происходит, например, с белком гемоглобином. Он осуществляет транспорт кислорода от клетки к клетке в составе крови. Для человека он незаменим.
- Запасная или резервная. Такие полипептиды накапливаются в растениях и яйцеклетках животных как источник дополнительного питания и энергии. Пример — глобулины.
- Двигательная. Очень важная функция, особенно для простейших организмов и бактерий. Ведь они способны передвигаться только при помощи жгутиков или ресничек. А эти органоиды по своей природе не что иное, как белки. Примеры таких полипептидов следующие: миозин, актин, кинезин и прочие.
Очевидно, что функции белков в организме человека и других живых существ очень многочисленны и немаловажны. Это еще раз подтверждает, что без рассматриваемых нами соединений невозможна жизнь на нашей планете.
Как происходит денатурации белка
Для того чтобы свойства и функции белка изменились, необходима денатурация. Что же это такое? Денатурация – это изменение изначальной структуры белка. Изменить ее можно, воздействуя на белок физическими или химическими факторами, вроде больших температур, механических воздействий или при помощи некоторых химических веществ. Наглядным примером денатурации является сваренное яйцо: из жидкого оно превращается в плотное. Белок перестаёт быть растворимыми и облегчает пищеварительными ферментам своё воздействие на него.
Однако, этот процесс обратим в том случае, если конструкция белка устанавливается особым порядком последовательности аминокарбоновых кислот в полипептидной цепи и его составом. В этом случае уже развёрнутая полипептидная цепь способна в произвольном порядке закрутиться спиралью и уложиться в единую. Эта способность основывается на системе раздражимости, свойственной всему живому.