Полимеразная цепная реакция
Содержание:
- ПЦР может работать в любой биологической среде
- Как выглядит бланк результатов ПЦР анализов
- Недостатки
- 5. Организация технологического процесса постановки ПЦР
- Комментарии и ссылки
- Анализ на ИППП
- 2.1 Наличие в реакционной смеси ряда компонентов
- Метод ПЦР
- Примечания
- Какие варианты проведения имеет метод ПЦР?
- Линейно разрушаемые зонды (по типу TaqMan®)
- Зачем проходить такую процедуру
- ПЦР диагностика инфекций
- Анализ методом ПЦР
- ПРЦ-исследование, что это такое?
- Преимущества и недостатки
ПЦР может работать в любой биологической среде
Метод ПЦР не отличается «кровожадностью», поэтому приемлет любую биологическую среду, содержащую предполагаемый инфекционный агент.Обычно выбор – что нужно взять для исследования, остается за врачом.
Таким образом, в поисках возбудителя, кроме анализа крови (хотя он тоже подходит и в большинстве случаях берется параллельно другому материалу), можно использовать:
- Мазок (выделения урогенитального тракта);
- Соскоб слизистых ротовой полости, конъюнктивы, носоглотки, половых путей (у женщин берут из шейки матки и влагалища, у мужчин – из уретры);
- Слюну;
- Сперму;
- Сок предстательной железы;
- Ткани плаценты и амниотиотическую жидкость (околоплодные воды);
- Осадок мочи (после центрифугирования), например, для выявления некоторых ИППП и микобактерий туберкулеза;
- Мокроту и плевральную жидкость с той же целью;
- Экссудаты;
- Спинномозговую жидкость при подозрении на инфекционное поражение ЦНС;
- Биопсийный материал (биоптат), взятый из печени, 12-перстной кишки, желудка и пр.
К вышеперечисленному хочется добавить, что материала для тестирования во всех случаях, даже в соскобах и выделениях, будет достаточно, так как тестирование методом ПЦР больших объемов не требует, анализу хватает и нескольких микролитров, которые обычно берут в микропробирку типа «эппендорф» и отправляют на исследование.
Как выглядит бланк результатов ПЦР анализов
Бланк результатов в основном выглядит как таблица.
В ней указаны строки с наименованиями инфекций, на которые проводится обследование.
Указаны не названия заболеваний, а конкретные виды микроорганизмов.
Например:
- Хламидия трахоматис;
- Гарднерелла вагиналис;
- Кандида альбиканс и т.д.
В столбцах напротив соответствующих видов указаны:
- результаты анализа (обнаружено, не обнаружено, либо количественные значения);
- единицы измерения (обычно копии ДНК на мл);
- референсные значения (то есть, норма – какие показатели должны быть у здоровых людей).
Указание референсных значений необходимо, так как некоторые микроорганизмы, определяемые в ходе ПЦР, могут присутствовать в урогенитальном тракте в норме.
К примеру, может проводиться исследование на лактобактерии, которые составляют основу биоценоза здоровой женщины.
Если же диагностируется кандидоз, то нормальным считается наличие грибков в количестве 10 в 3 степени копий ДНК и меньше.
Недостатки
Безусловно, ПЦР не идеальный метод, имеются и свои недостатки. Но они напрямую связаны с его достоинствами и с так называемым «человеческим фактором». ПЦР – очень высокотехнологичный метод, требующий соблюдения строжайших правил оснащения лаборатории. Достаточно сказать, что в помещении должен быть установлен фильтр биологической очистки со степенью 99,9%.
Оценивать результаты реакции должен практический врач, который лечит конкретного больного. Дело в том, что далеко не всегда положительный ответ теста означает наличие заболевания. Например, человек пролечился от какого-либо заболевания, но погибший и уже не опасный возбудитель будет еще некоторое время «разбираться на запчасти» защитной системой организма. Если в этот момент сделать ПЦР – результат окажется положительным.
Другой вариант – это отрицательный результат ПЦР при наличии даже явной клинической картины. Одна из наиболее возможных причин – материал для исследования был взят «не оттуда». Образец должен брать квалифицированный врач, строго следуя инструкции, которую ему дает лаборатория.
5. Организация технологического процесса постановки ПЦР
Потенциально высокая чувствительность полимеразной цепной реакции делает совершенно необходимым особенно тщательное устройство ПЦР-лаборатории. Это связано с наиболее острой проблемой метода — контаминацией.
Контаминация — попадание из внешней среды в реакционную смесь специфических молекул ДНК, способных служить мишенями в реакции амплификации и давать ложноположительные результаты.
Существует несколько способов борьбы с этим неприятным явлением. Одним из них является использование фермента N-урацил-гликозилазы (УГ). В основе этого метода лежит способность УГ расщеплять молекулы ДНК со встроенным урацилом. Реакцию амплификации проводят с использованием смеси дНТФ, в которой дТТФ заменен на урацил, и после термоциклирования все образующиеся в пробирке ампликоны будут содержать урацил. Если до амплификации в реакционную смесь добавить УГ, то попавшие в реакционную смесь ампликоны будут разрушены, тогда как нативная ДНК останется целой и будет в дальнейшем служить мишенью для амплификации.
Таким образом, этот метод лишь в некоторой степени позволяет устранить источник контаминации и не гарантирует от ложноположительных результатов.
Другой способ борьбы с результатами контаминации, значительное уменьшение количества циклов реакции (до 25-30 циклов). Но даже при таком подходе риск получения ложноположительных результатов велик, т.к и в этом случае при отсутствии ингибиторов легко получить продукт амплификации из-за контаминации.
Таким образом, несмотря на пользу преамплификационных мероприятий, направленных на инактивацию молекул ДНК, служащих причиной возникновения ложноположительных результатов, наиболее радикальным средством является заранее продуманная организация лаборатории.
Комментарии и ссылки
- абы Mullis, Kary (1998). Dancing Naked in the Mind Field. New York: Pantheon Books. ISBN 0-679-44255-3.
- Rabinow, Paul (1996). Making PCR: A Story of Biotechnology. Chicago: University of Chicago Press. ISBN 0-226-70146-8.
- Mullis KB. The unusual origin of the polymerase chain reaction. Sci Am 1990; 262 (4): 56-61, 64-5.
- Advice on How to Survive the Taq Wars 2: GEN Genetic Engineering News Biobusiness Channel: Article. May января 2006
- Отжиг (англ. Annealing) — гибридизация фрагментов ДНК
- Шпилька — внутримолекулярная самокомплементарна структура
- Диммеры праймеров — межмолекулярные структуры, образующиеся праймерами друг с другом или с самим собой
Анализ на ИППП
ПЦР на ЗППП назначают при подозрении на скрыто протекающие вирусные инфекции, микоплазмоз, уреаплазмоз. Признаки, указывающие на эти заболевания:
- частые циститы, уретриты;
- женское и мужское бесплодие;
- хронические тазовые боли;
- нарушение менструального цикла у женщин.
ПЦР мазок на хламидии сдают женщины при подготовке к беременности, наличии хронических гинекологических заболеваний.
Герпес
Генитальный герпес — хроническое заболевание, протекает циклически. Обострения возникают на фоне стрессов, простуд, переохлаждений. Характерный симптом — пузырьковая сыпь на коже и слизистых, сопровождается сильным зудом, жжением. Герпес передается при половых контактах.
Вирус папилломы человека
ВПЧ — вирус папилломы человека. Инфекция хроническая, заражение происходит с началом половой жизни. Существует несколько типов ВПЧ, часть из них обладает высоким онкогенным риском — то есть повышает вероятность развития рака шейки матки у женщин.
ПЦР на ВПЧ рекомендуется ежегодно сдавать женщинам с эрозией шейки матки, хроническими гинекологическими заболеваниями. При выявлении вируса проводится прижигание эрозии. Противовирусных препаратов против ВПЧ нет. Защититься от вируса папилломы можно вакцинацией. Ее делают девочкам в возрасте 8-12 лет, допускается сделать прививку девушкам до начала половой жизни.
2.1 Наличие в реакционной смеси ряда компонентов
Праймеры
— пара искусственно синтезированных олигонуклеотидов, имеющих, как правило, размер от 15 до 30 п. н., идентичные соответствующим участкам ДНК-мишени. Они играют ключевую роль в образовании продуктов реакции амплификации. Правильно подобранные праймеры обеспечивают специфичность и чувствительность тест-системы.
Taq-полимераза
— термостабильный фермент, обеспечивающий достраивание 3’-конца второй цепи ДНК согласно принципу комплементарности.
Смесь дезоксинуклеотидтрифосфатов (дНТФ)
— дезоксиаденозинтрифосфат (дАТФ), дезоксигуанозинтрифосфат (дГТФ), дезоксицитозинтрифосфат (дЦТФ) и дезокситимидинтрифосфат (дТТФ) — «строительный материал», используемый Taq-полимеразой для синтеза второй цепи ДНК;
Буфер
— смесь катионов и анионов в определенной концентрации, обеспечивающих оптимальные условия для реакции, а также стабильное значение рН;
Анализируемый образец
— подготовленный к внесению в реакционную смесь препарат, который может содержать искомую ДНК, служащую мишенью для последующего многократного копирования (например, ДНК микроорганизмов). При отсутствии ДНК-мишени специфический продукт амплификации не образуется.
Метод ПЦР
ПЦР — это метод полимеразной цепной реакции. О нем наслышаны многие, хотя до эпидемии значение аббревиатуры ПЦР было знакомо лишь криминалистам, генетикам, а также лабораторным работникам, определяющим ВИЧ, сифилис, гепатиты, туберкулез и еще ряд заболеваний.
Как работает ПЦР и какие бывают вирусы
ДНК — это двойная спираль, кодирующая генетическую информацию, в том числе, вирусов. Обе части ДНК соединены по принципу комплементарности. То есть, один элемент может соединяться только с соответствующим ему. Например, гуанин (G) только с цитозином(C). ДНК-содержащие вирусы — это вирус герпеса, оспы, гепатита В. Коронавирус относится к РНК-содержащим вирусам.
Для исследования методом ПЦР берется мазок из ротоглотки. Если в материал для анализа попала вирусная частица, то в лаборатории одна нить ее РНК достраивается до двойной спирали ДНК.
РИА Новости/Сергей Пивоваров
В чем суть метода ПЦР?
Вместо того, чтобы искать иголку в стоге сена (одну нить вирусной частицы), можно сделать целый «клубок» нитей, найти которые не составит труда. Нуклеотидная последовательность («буквы») РНК вируса уже расшифрована. И к этим «буквам» по принципу комплиментарности присоединяются в результате химической реакции другие. В итоге получается молекула ДНК. Она служит матрицей. Затем ее многократно размножают примерно по той же технологии. ДНК помещают в раствор со специальным набором химических веществ в устройство-амплификатор, в котором периодически меняется температура от 50 до 92 градусов. В нем, как в ксероксе, ДНК копируется.
Финальный этап исследования – электрофорез, на нем можно увидеть размноженные копии ДНК. ДНК заряжена отрицательно, и в электрическом поле ее притягивает положительный заряд. Притягиваясь к нему, размноженная ДНК проходит через краситель. Чем больше фрагмент ДНК, тем медленнее он двигается и тем ярче окрашивается.
Если в биоматериале пациента не было вирусной частицы, то и первая цепочка ДНК не выстроится – химическим веществам, подобранным для строительства, не за что будет «зацепиться». Соответственно, форез ничего не покажет.
Примечания
- Mullis, Kary B. et al. «Process for amplifying, detecting, and/or-cloning nucleic acid sequences»
- Saiki R.K., Scharf S., Faloona F., Mullis K.B., Horn G.T., Erlich H.A., Arnheim N. Science 1985 Dec 20; 230 (4732): 1350-4; Enzymatic amplification of beta-globin genomic sequences and restriction site analysis for diagnosis of sickle cell anemia.
- Каледин А. С., Слюсаренко А. Г., Городецкий С. И. // Биохимия. — 1980. — T. 45. — C. 644—651.
- Alice Chien, David B. Edgar и John M. Trela. Deoxyribonucleic Acid Polymerase from Extreme Thermophilic Thermus aquaticus. Jourmal of Bacteriology, Sept. 1976, pp. 1550—1557.
- 1 kbp (kilo base pair (англ.)) — 1 тысяча пар оснований, единица измерения длины ДНК
- Отжиг (англ. annealing) — гибридизация фрагментов ДНК
- Шпилька — внутримолекулярная самокомплементарная структура
- Димер — межмолекулярные структуры, образуемые праймерами друг с другом или сами с собой
- United States Patent 7,972,820. July 5, 2011. Isothermal amplification of nucleic acids on a solid support
Какие варианты проведения имеет метод ПЦР?
Наиболее популярными вариантами в лабораториях диагностических являются:
- с обратной транскрипцией ПЦР;
- с «горячим» стартом ПЦР – в реакционную среду вводятся блокирующие активность полимеразы антитела, что обеспечивает запуск реакции в строго определенный момент;
- с анализом результатов по «конечной точке» ПЦР ‑ итог оценивается по наличию флуоресценции в неоткрытом сосуде, что устраняет риск загрязнения реакционной среды (применяются ДНК-зонды с флуорофорной меткой);
- в режиме «реального времени» ПЦР (ПЦР-РВ, Real-Time PCR) –метод количественный, в котором участвуют красители флуоресцентные, способные встраиваться внутрь спирали ДНК, увеличивая интенсивность свечения, и после каждого цикла копирования по интенсивности флуоресценции определяют количество воспроизведенных молекул;
- мультиплексная (мультипраймерная) ПЦР – в одном сосуде амплифицируется две и больше ДНК-последовательности, что позволяет определять несколько патогенов одновременно.
Для различных исследовательских целей применяются следующие варианты метода ПЦР:
- гнездовая («вложенная») – с двумя праймерными парами, где вторая пара воспроизводит участок ДНК молекулы, полученной в первой реакции, тем самым уменьшая число нежелательных реакций;
- «инвертированная» ‑ реализуется, когда известен только маленький фрагмент внутри искомой последовательности (ДНК разрезается ферментами рестриктазами, а затем закольцовывается так, чтобы известные кусочки оказались на конечных участках исследуемого фрагмента);
- асимметричная – применяется, если надо воспроизвести исключительно одну цепочку молекулы, поэтому один праймер берется в значительном избытке;
- молекулярных колоний метод – используется акриламидный гель, который полимеризуется с реагентами ПЦР на поверхности и в итоге реакции формируются молекулярные колонии в определенных зонах полимера;
- длинных фрагментов – проводится амплификация участков из 10 тысяч и более нуклеотидов;
- ступенчатая – начальные циклы проводятся в высокотемпературных условиях для повышения специфичности сцепления праймеров, а после накопления молекул температура снижается;
- случайных полиморфных фрагментов (RAPD) – дает возможность дифференцировать микроорганизмы с похожими по структуре ДНК;
- иммуно-ПЦР – исследуются антигены, а не нуклеиновые кислоты, путем предварительного присоединения антител с ДНК-меткой и последующим воспроизведением;
- групп-специфическая;
- с быстрой амплификацией концов кДНК;
- виртуальная и др.
Выяснив, для чего проводится ПЦР анализ, что это такое (цена заметно различается для разных методов), пациент понимает, чего ему ожидать от исследования.
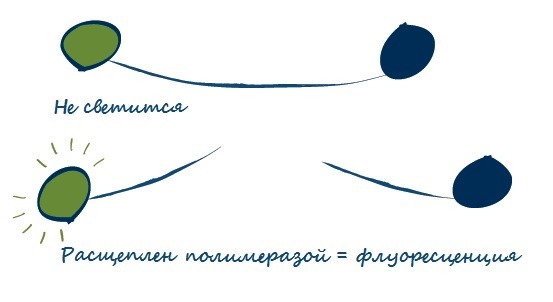
Линейно разрушаемые зонды (по типу TaqMan®)
ДНК-зонды представляют собой меченые флуоресцентными красителями олигонуклеотиды (короткие фрагменты ДНК). Их нуклеотидная последовательность такова, что они гибридизируются на матричной молекуле ДНК рядом с праймером и дают флуоресцентный сигнал. 5’-конец зонда мечен репортерным флуоресцентным красителем. Чаще всего используется зеленый краситель FAM, но также могут использоваться VIC, ROX, CY5 и другие, которые флуоресцируют на другой длине волны, благодаря чему возможно проводить одновременный анализ по разным каналам детектора. На 3’-конце зонда располагается молекула гасителя – она обеспечивает подавление флуоресценции метки. Таким образом, когда репортерный краситель и его гаситель находятся на физически близком расстоянии друг от друга, общий уровень флуоресценции низкий.
В процессе ПЦР зонд прикрепляется к матричной молекуле ДНК сразу после праймера. Далее, зонд расщепляется полимеразой во время реакции. За счет этого молекула гасителя оказывается далеко от репортера, его флуоресценция возрастает, и так происходит на каждом цикле ПЦР.
Зачем проходить такую процедуру
Поскольку ПЦР — высокоэффективный способ диагностики, дающий почти 100% результат, процедуру используют:
- для подтверждения или исключения окончательного диагноза;
- быстрой оценки эффективности проводимой терапии.
Во многих случаях ПЦР — единственно возможный тест для обнаружения развивающегося заболевания, если прочие бактериологические, иммунологические и вирусологические методики диагностирования оказываются бесполезными.
- Вирусы обнаруживаются с помощью процедуры ПЦР сразу после инфицирования и до появления признаков болезни. Раннее выявление вируса позволяет оперативно назначить лечение.
- Так называемая «вирусная нагрузка» (или — количество вирусов в организме) также определяется при анализе ДНК количественным методом.
- Конкретные болезнетворные организмы (например, туберкулезную палочку Коха) сложно и слишком долго культивировать. Анализ ПЦР позволяет быстро выявить минимальное количество патогенов (живых и мертвых) в образцах, удобных для исследования.
Подробный анализ ДНК патогена используется:
- чтобы определить его чувствительность к конкретным видам антибиотиков, что позволяет немедленно приступить к лечению;
- чтобы контролировать распространение эпидемий среди домашних, диких животных;
- чтобы выявить и отслеживать новые заразные виды микробов и подтипы патогенов, которые спровоцировали предыдущие эпидемии.
При выполнении исследования ПЦР раз за разом в реакторе (амплификаторе или термоциклере) повторяются определенные циклы:
- Первый шаг – денатурация. Слюну, кровь, биоптат, гинекологические пробы, мокроту, в которых подозревается присутствие ДНК (или РНК) патогена, помещают в амплификатор, где происходит нагревание материала и расщепление ДНК на две отдельные цепочки.
- Второй шаг – отжиг или небольшое охлаждение материала и добавление к нему праймеров, способных распознавать нужные участки в молекуле ДНК и связываться с ними.
- Третий шаг – элонгация – происходит после присоединения 2 праймеров к каждой из цепочек ДНК. В ходе процесса фрагмент ДНК патогена достраивается, и формируется его копия.
Про расшифровку результатов и вывод исходя из ПЦР-реакции читайте ниже.
ПЦР диагностика инфекций
Мазок ПЦР у женщин, что это такое, для чего берется и по каким правилам? Данное исследование позволяет очень точно выявить возбудителей различных инфекций и виновников воспалительных процессов (вульвовагинитов). Берется ПЦР анализ у живущих половой жизнью и никогда не обследовавшихся, планирующих беременность, имевших незащищенные половые контакты, мазок сдают и женщины, и мужчины.
Полимеразная цепная реакция, именно так расшифровывается ПЦР, дает возможность в небольшом количестве взятого на анализ материала найти генетическую информацию инфекционного возбудителя. Самым распространенным является мазок методом ПЦР на ИППП (хламидии, уреаплазмы, микоплазмы), кстати, эти же инфекции относятся к разряду «скрытых», не дающих явной симптоматики и не выявляющихся при обычных, рядовых исследованиях. Часто проводится диагностика герпетических инфекций, а также различных типов папилломавирусной инфекции
При этом особое внимание уделяется тем типам, которые вызывают рак шейки матки, то есть онкогенным
Мазок ПЦР на хламидии и другие инфекции берут у будущих мам, если те во время планирования ребенка его не сдавали. Данное исследование обязательно необходимо, так как скрытые инфекции, передающиеся половым путем, могут много лет «сидеть» в организме, никак себя не проявляя, но очень навредят будущему ребенку, могут привести к выкидышу, преждевременным родам, внутриутробной инфекции, а вследствие этого гибели плода. Конечно, лучше проводить лечение на этапе планирования ребенка, но если ПЦР диагностика инфекций их обнаружила уже после зачатия — не беда, есть современные безопасные препараты, которые можно принимать будущим мамам.
Многие женщины боятся сдавать анализы, наслушавшись и начитавшись о том, что любые манипуляции «там» врача могут спровоцировать выкидыш. А тем более нельзя сдавать мазок ПЦР при беременности, так как материал берется из шейки матки, а не с ее поверхности. Но это не страшно. Длина шейки матки немаленькая. Инструмент не попадет в матку, никак не затронет ребенка. И шейку расширять для взятия биоматериала не нужно. Мазок из цервикального канала безопасен для матери и ребенка и безболезненен.
Делается данное исследование не только с целью обнаружения инфекций, передающихся половым путем, но и возбудителей бактериального вагиноза и кандидоза — гарднерелл и грибов рода Кандида. Так что, расшифровка мазка на ПЦР диагностику бывает полезна и в таких «банальных» случаях.
Чтобы получить точный результат анализа, нужно соблюдать несколько простых правил перед его сдачей. Подготовка к мазку на ПЦР очень проста.
1. Нельзя мочиться за 3 часа до сдачи анализа.
2. Исследование проводится вне приема антибиотиков и антибактериальных средств.
3. Лучше сдавать мазок в середине цикла, но не перед самым началом менструации или сразу после завершения.
4. За 2-3 суток до исследования не использовать местных средств контрацепции и вагинальных препаратов.
5. В течение нескольких часов до сдачи мазка нельзя подмываться и спринцеваться.
6. Половую жизнь нужно прекратить минимум за 1,5 суток до взятия материала.
7. Сдачу мазка следует немного отложить, если накануне были взяты кольпоскопические пробы для выявления заболеваний шейки матки.
Анализ методом ПЦР
ПЦР анализ — что это такое? Это метод использует принципы молекулярной биологии. Для исследования материала применяются особые ферменты, которые многократно и быстро копируют ДНК, РНК фрагменты возбудителей болезни. Существует разные виды ПЦР анализа в зависимости от исследуемого материала (кровь, моча, кал и т.д.). После обработки сотрудники лаборатории сравнивают с базой данных полученный результат, выявляют концентрацию, тип возбудителя.
Анализ на ПЦР помещают в специальный амплификатор (прибор), который нагревает и охлаждает пробирки с биоматериалом. Изменения температуры нужны для репликации фрагментов. Точность результата будет зависеть от точности температурного режима. Метод полимеразной цепной реакции помогает выявить:
- инфекционный мононуклеоз;
- ВИЧ;
- цитомегаловирусную инфекцию;
- вирусные гепатиты G, C, B, A;
- инфекции/заболевания, передающиеся половым путем (ИППП/ЗППП): гарднереллез, трихомониаз, уреаплазмоз;
- герпетическую инфекцию;
- онкогенные вирусы;
- листериоз;
- хеликобактерную инфекцию;
- клещевой энцефалит, боррелиоз;
- туберкулез;
- кандидоз.
Крови
На данный момент из-за новизны технологии анализ крови методом ПЦР все еще имеет высокую цену. Для подготовки биоматериала не нужно соблюдать определенные требования. Даже вызванные физическими нагрузками, стрессами, сменой рациона питания изменения состава не влияют на результат исследования. ПЦР анализ крови может испортить только прием антибактериальных средств, поэтому перед сдачей необходимо выдержать паузу между лечением и тестом.
ПЦР исследование крови – самый распространенный вариант диагностики хронических, острых инфекционных патологий при вирусном или атипичном проявлении. Серологические методы исследования имеют определенную трудность при проведении – определение наличия возбудителя проводится по наличию антител в организме человека. Результат мог быть ложноотрицательным, если состояние больного не давало время для их выработки.
Мазка
В сфере гинекологии для исследования наличия инфекционных микроорганизмов используют ПЦР анализ мазка. Работа с материалом проводится по тому же принципу, что и с кровью: многократное увеличение фрагментов ДНК возбудителя, чтобы с легкостью его идентифицировать. Это же помогает обнаружить скрытые инфекции у женщины. Для проведения анализа могут быть взяты разные биологические жидкости: слюна, мокрота, моча, кровь. В гинекологии для точности определения чаще используется мазок со слизистой влагалища из цервикального канала.
Для проведения ПЦР существуют определенные показания. Нередко его нужно сделать, чтобы выявить устойчивый к антибиотикам вид возбудителя. У женщин основными показаниями для диагностики по этому методу выступают:
- беременность, которая протекает тяжело;
- острая фаза ИППП;
- если есть подозрение на переход ИППП в хроническую стадию;
- поиск причин бесплодия.
Кала
Для выявления инфекции может быть назначен со стороны врача анализ кала на ПЦР. Для того, чтобы получить максимально достоверные результаты после теста, необходимо придерживаться следующих правил перед забором биоматериала:
- за несколько суток прекратить прием слабительных препаратов: масла, свечи;
- исключить медикаменты, которые дают специфическую окраску калу, к примеру, с содержанием железа.
Для забора следует использовать стерильную палочку и контейнер. Чем-либо их дополнительно протирать, ополаскивать не нужно. При сборе материала будьте осторожны, вы не должны задеть рукой внутренние стенки контейнера. Следите, чтобы в кале не было примесей мочи, нельзя использовать дополнительные вспомогательные средства для испражнения (клизма). Собирать материал нужно в день сдачи, хватит 1/3 объема контейнера. Данный метод диагностики имеет следующие преимущества:
- Анализ способен указывать на ДНК паразита, другие же тесты могут определять только остатки их жизнедеятельности.
- Высокая точность, будет установлен возбудитель.
- Ультрачувствительный анализ, который способен выявить даже одну клетку вируса.
- Результат исследования ПЦР будет готов через 4-5 часов.
Мочи
При необходимости для проведения теста врач может взять для исследования мочу. Высокая точность открывает возможность работать с любой биологической жидкостью, из которой удается извлечь ДНК вируса. Чтобы сдать анализ мочи ПЦР, нужно придерживаться таких ограничений перед забором материала:
- минимум за 1 день до процедуры прекратить половые контакты;
- за 3 недели до сдачи должно быть окончено любое антибактериальное лечение, потому что медикаменты смажут картину;
- сдавать анализ нужно натощак (жидкость тоже запрещена);
- брать нужно первую утреннюю порцию материала.
ПРЦ-исследование, что это такое?
Анализ на ПЦР заключается в копировании ДНК и РНК возбудителя в лабораторных условиях. Так как основным хранилищем генетической информации является ДНК (дезоксирибонуклеиновая кислота), образованная 2 нитями, соединенными нуклеотидами, именно при множественном копировании (синтезе) этой кислоты можно установить наличие патогенного организма, если речь идет о бактерии.
Бактерии имеют свою собственную оболочку, защищающую их от внешней среды, которая нередко является агрессивной по отношению к последним. У вирусов же нет собственной оболочки (у некоторых представителей имеется нечто похожее на оболочку), а информацию в себе несет не ДНК, а РНК (рибонуклеиновые кислоты).
РНК устроены таким образом, что они встраиваются в цепи ДНК организма-переносчика и меняют их, позволяя проникать в клетки и жить за счет организма. Грубо говоря, бактерии и вирусы оставляют «отпечатки» своими ДНК и РНК, которые и выявляет анализ ПЦР. Эти «отпечатки», как и отпечатки пальцев, являются уникальными для каждого возбудителя. Поэтому ПЦР позволяет выявить заболевание на любых этапах, даже если развитие патогена происходит бессимптомно.
До широкого внедрения ПЦР в гинекологии и урологии на ИППП широко использовались методы:
- микроскопия — окрашенные и неокрашенные препараты исследуются через микроскоп. Метод очень завязан на опытности лаборанта. Таким методом хорошо выявляются бактерии, имеющие большой размер (гарднереллы, кандиды, трихомонады, гонококки);
- бактериология — метод заключается в выращивании возбудителей инфекции на питательном агаре, идентификации возбудителя и определения чувствительности его к антибиотикам. Долгое время считался «золотым стандартом». К минусам относят необходимость быстрой доставке материала в КДЛ (клинико-диагностическая лаборатория), сроки выращивания и выяснения чувствительности к группам антибактериальных препаратов (как правило, 5-7 суток);
- иммуноферментный анализ — Определение антител организма, возникающих в ответ на внедрение антигена возбудителем инфекции. Из плюсов стоит отметить возможность определения стадии заболевания (острая стадия сопровождается наличием IgG в сыворотке крови, хроническая – IgM.) К минусам относится невозможность определения у людей с ослабленным иммунитетом, а также специфичность ИФА. Другими словами, при наличии только результата иммуноферментного анализа, невозможно было выставить диагноз, а можно было только определить, что организм борется с какой-либо инфекцией.
Преимущества и недостатки
За широкий перечень преимуществ автор методики получил Нобелевскую премию, как подтверждение признания специалистов универсальности и высоких возможностей такого способа диагностики.
К неоспоримым достоинствам ПЦР можно отнести следующие:
- Очень высокая чувствительность. Обычно говорят о чувствительности от 95 до 100%, но это усредненные данные. Этот показатель отличается для разных микроорганизмов. Так, для гепатита С он не бывает ниже 97% (при условии выполнения всех требований), а для определения уреаплазмоза — не менее 99%. Такая чувствительность является самой высокой на данный момент, поэтому способ почти не имеет конкурентов по этой характеристике.
- Возможность применения на самых ранних стадиях. В то время, когда другие методы диагностики еще не способны выявить возбудителя из-за его малого количества в образце пробы, ПЦР уже выдает корректный результат. Обнаружить присутствие возбудителя можно даже при наличии единственного экземпляра, а в некоторых случаях — только фрагмента микроба. По этой причине способ применяется и при хронических или скрытых течениях патологий, а также в стадии инкубации.
- Широкий спектр результатов. Анализ способен выявить одновременно несколько возбудителей, для этого не понадобится проводить повторные манипуляции. Иногда удается найти возбудителей, которые даже не предполагались при первичной диагностике.
- Универсальность образцов. В качестве пробы могут быть представлены образцы крови, слюны, мокроты, волосы, выделения из влагалища, клетки разных тканей.
- Скорость получения результатов. В большинстве случаев ответ получают через 5-6 часов. Для культурального анализа, приближающегося к полимеразной цепной реакции в плане точности, такой же результат можно получить в срок от нескольких дней до пары недель.
- Количественное определение возбудителя. Этот параметр позволяет определять титр микробов в материале, а это свойство часто необходимо для оценки эффективности выбранной тактики лечения.
- Выявление самого микроорганизма, а не определение его реакций. Большинство анализов основаны на ответной реакции возбудителя на химические реактивы, окрашивание и т. д. Этот способ диагностики позволяет обнаруживать непосредственно микроб, а не косвенные признаки, антитела и т. п.
Несмотря на такой широкий перечень преимуществ, у метода есть и некоторые недостатки:
- Из-за загрязнения пробы предыдущим образцом может произойти ложное выявление микроорганизмов. Такое происходит при загрязнении инструментов или реактивов, участвующих в ходе анализа. Даже в воздухе присутствуют фрагменты микробов, способных отразится на результате, поэтому в таких лабораториях обязательно должен быть установлен биологический фильтр с максимальной степенью очистки воздуха.
- Ложноотрицательный результат. Даже при всех явных проявлениях болезни иногда получают отрицательные данные. Причина этого – в неверно выбранном месте для взятия образца, поэтому персонал лаборатории должен обладать достаточной квалификацией, знаниями и опытом.
- Оценка данных должна производиться исключительно лечащим врачом, потому что интерпретация результатов ПЦР-анализа — сложный процесс. Наличие положительного ответа не всегда означает болезнь. Дело в том, что после того, как заболевание успешно пролечено, фрагменты возбудителя долго присутствуют в крови, поэтому заключение может сделать только очень квалифицированный специалист.
- Высокая стоимость диагностики с применением полимеразной цепной реакции. Цена обусловлена дорогостоящим оборудованием и высокими требованиями к условиям лабораторий и квалификации персонала.
Обязательные условия для получения точных данных в ПЦР-лабораториях:
- корректный механизм забора проб и их правильная транспортировка в лабораторию;
- точное соблюдение методик в ходе выполнения анализа;
- высокая стерильность и максимальная автоматизация процесса;
- использование одноразовых инструментов;
- система внутрилабораторного контроля для подтверждения достоверности данных.
При условии выдерживания всех требований на основе данных, полученных при помощи методики ПЦР, можно не только определить болезнь, но сделать прогноз ее течения и составить алгоритм лечения.